
【题目】(双选)下列关于烯烃、炔烃的叙述中,正确的是( )
A. 某物质的名称为2—乙基—1—丁烯,它的结构简式为![]()
B. CH3—CH===CH—C≡C—CF3分子结构中最多有4个碳原子在一条直线上
C. 相同物质的量的乙炔与苯分别在足量的氧气中完全燃烧,消耗氧气的量相同
D. β月桂烯的结构如图![]() 所示,该物质与等物质的量溴发生加成反应的产物(不考虑立体异构)理论上最多有5种
所示,该物质与等物质的量溴发生加成反应的产物(不考虑立体异构)理论上最多有5种
【答案】AB
【解析】
A.烯烃命名时应选择含有官能团的最长碳链做主链;B.与碳碳三键相连的碳原子在同一直线上;C.相同物质的量的烃燃烧,碳原子个数越大,耗氧量越大;D.β月桂烯可以发生单烯烃加成和共轭二烯烃加成。
2—乙基—1—丁烯的结构简式为![]() ,A正确;分子中碳链空间结构为平面型,如图所示
,A正确;分子中碳链空间结构为平面型,如图所示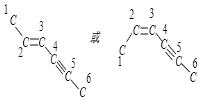 乙炔为直线型结构,-C≡C-决定了3、4、5、6号4个碳原子在同一直线上,B正确;根据烃燃烧的通式CxHy~(x+
乙炔为直线型结构,-C≡C-决定了3、4、5、6号4个碳原子在同一直线上,B正确;根据烃燃烧的通式CxHy~(x+![]() )O2可知,在物质的量相等的条件下,完全燃烧消耗,(x+
)O2可知,在物质的量相等的条件下,完全燃烧消耗,(x+![]() )越大,消耗的氧气越多,则苯的耗氧量大于乙炔,C错误;根据结构简式
)越大,消耗的氧气越多,则苯的耗氧量大于乙炔,C错误;根据结构简式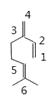 编号可知,如果是单烯烃加成,可以发生1,2-加成、3,4-加成、5,6-加成,如果是共轭二烯烃加成,可以发生1,4—加成,不考虑立体异构可以得到4种加成产物,D错误。
编号可知,如果是单烯烃加成,可以发生1,2-加成、3,4-加成、5,6-加成,如果是共轭二烯烃加成,可以发生1,4—加成,不考虑立体异构可以得到4种加成产物,D错误。


科目:高中化学 来源: 题型:
【题目】在体积固定的密闭容器中加入2mol A和1mol B,发生反应:2A(g)+B(g)![]() 3C(g)+D(g),达到平衡时C的浓度为a mol/L.若维持容器体积和温度不变,按下列四种配比作为起始物质,达到平衡后,C的浓度仍为a mol/L的是
3C(g)+D(g),达到平衡时C的浓度为a mol/L.若维持容器体积和温度不变,按下列四种配比作为起始物质,达到平衡后,C的浓度仍为a mol/L的是
A. 4 mol A+2 mol B B. 2 mol A+1 mol B+1 mol He
C. 3 mol C+2 mol D D. 2 mol A+1 mol D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.01000 mol·L-1的盐酸滴定0.01000 mol·L-1NaA溶液20.00mL。滴定曲线如图所示,下列说法错误的是( )
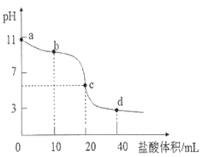
A. 当滴入盐酸以后,c(HA)+c(A-)<0.01000 mol·L-1
B. b点溶液中微粒浓度大小关系为:c(HA)>c(A-)>c(Cl -)>c(OH-)>c(H+)
C. c点时,溶液中微粒浓度关系为:c(Na+)<c(HA)+2c(A-)
D. d点时,溶液中微粒浓度存在关系:c(Na+)+c(H+)=c(Cl-)+c(OH-)+c(A-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某有机物X的结构简式为 ,下列有关叙述不正确的是 ( )
,下列有关叙述不正确的是 ( )
A. 1 mol X分别与足量的Na、NaOH溶液、NaHCO3溶液反应,消耗这三种物质的物质的量分别为3 mol、4 mol、1 mol
B. X在一定条件下能与FeCl3溶液发生显色反应
C. X在一定条件下能发生消去反应和酯化反应
D. X的化学式为C10H10O6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(双选)关于烃的下列叙述中,正确的是( )
A. 通式为CnH2n+2的烃一定是烷烃 B. 通式为CnH2n的烃一定是烯烃
C. 分子式为C4H6的烃不一定是炔烃 D. 分子量为128的烃不一定是烷烃
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,a曲线表示一定条件下可逆反应:X(g)+Y(g) ![]() 2Z(g)+W(g) △H<0 的反应过程中X的转化率和时间的关系,若使a曲线变为b曲线,可采取的措施是
2Z(g)+W(g) △H<0 的反应过程中X的转化率和时间的关系,若使a曲线变为b曲线,可采取的措施是

A. 加入催化剂 B. 增大Y的浓度
C. 降低温度 D. 增大体系压强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】晶体与非晶体的本质区别是( )
A.晶体有规则的几何外形,而非晶体没有规则的几何外形
B.晶体内部粒子有序排列,而非晶体内部粒子无序排列
C.晶体有固定的熔点,而非晶体没有固定的熔点
D.晶体的硬度大,而非晶体的硬度小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ⅰ用1~18号元素符号及其形成的化合物的化学式填空。
(1)原子半径最小的元素是_____。
(2)与水反应最剧烈的金属是____。
(3)最高价氧化物的水化物碱性最强的是______。
(4)最高价氧化物的水化物为两性氢氧化物的是____________。
(5)气态氢化物的水溶液呈碱性的元素是______。
ⅱ(6)写出CO2、H2O2的电子式:
CO2__________、H2O2__________。
(7)用电子式表示HCl和MgBr2的形成过程:
HCl__________;MgBr2__________。
ⅲ用![]() X表示原子:
X表示原子:
(8)中性原子的中子数N=________;
(9)AXn-共有x个电子,则该阴离子的质子数Z=______;
(10)12C16O2分子中的中子数N=_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验。
Ⅰ.(1)将钠、钾、镁、铝各1 mol分别投入到足量的同浓度的盐酸中,试预测实验结果:________与盐酸反应最剧烈,________与盐酸反应产生的气体最多。
(2)向Na2S溶液中通入氯气出现黄色浑浊,可证明Cl的非金属性比S强,反应的离子方程式为___________________。
Ⅱ.利用如图装置可验证同主族元素非金属性的变化规律
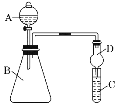
(3)仪器B的名称为____________,干燥管D的作用是防止_____________________。
(4)若要证明非金属性:Cl>I,则A中加浓盐酸,B中加KMnO4,(KMnO4与浓盐酸常温下反应生成氯气),C中加淀粉碘化钾混合溶液,观察到C中溶液的现象___________,即可证明。请写出一种制取氯气的化学反应方程式:_______________________________________,从环境保护的角度考虑,此装置缺少尾气处理装置,可用___________溶液吸收尾气。
(5)若要证明非金属性:C>Si,则在A中加盐酸、B中加CaCO3、C中加Na2SiO3溶液,观察到C中溶液________________________的现象,即可证明。但有的同学认为盐酸具有挥发性,可进入C中干扰实验,应在两装置间添加装有__________溶液的洗气瓶。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com