
 轻松暑假总复习系列答案
轻松暑假总复习系列答案科目:高中化学 来源: 题型:
 (I)在铝热反应 Fe2O3+2Al
(I)在铝热反应 Fe2O3+2Al
| ||
查看答案和解析>>
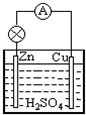
科目:高中化学 来源:2014届甘肃省金昌市高一期中考试(文)化学试卷(解析版) 题型:选择题
下列关于Cu—Zn原电池的说法正确的是
A、在原电池中,电子流出的一极为负极
B、原电池中,发生还原反应的电极是负极
C、原电池中,电流的方向是从负极到正极
D、在Cu—Zn原电池中,Cu做负极
查看答案和解析>>
科目:高中化学 来源:2010-2011学年四川省高三第七次月考化学卷 题型:选择题
NA表示阿伏加德罗常数的值,下列说法正确的是
A.标况下,22.4LNO2气体中含有NA个氮原子
B.在Cu-Zn原电池中,正极产生1.12LH2时,负极产生了0.05 NA 个 Zn2+
C.常温常压下,1molCl2与足量的Fe反应转移3NA个电子
D.标况下,将m1克锌加入到m2克20%的盐酸中放出nLH2,则转移电子数为nNA/11.2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com