
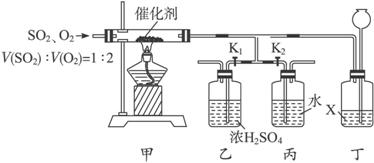
��1��д����������������Ӧ�Ļ�ѧ����ʽ_________________________________________��
��2���ڹ�ҵ�����У���װ�ü�������ͬ���豸������____________����װ����������ͬ���豸������____________��
��3����Ӧ��ͨ���V��SO2����V(O2)=1��2����Ŀ����___________________________��
��4��ʵ��ʱ�ȹر�K1����K2����һ����ٴ�K1���ر�K2����װ���Һͱ��в�����������____________��
��5����֪Һ��X�Ȳ����ܽ���������Ҳ�����ܽ���������װ�ö���������________________________��
��6������װ������һ�����Ե�ȱ�ݣ���ָ��____________________________________���Ľ��ķ�����____________________________________��
��1��4FeS2+11O2![]() 2Fe2O3+8SO2
2Fe2O3+8SO2
��2���Ӵ��� ������
��3��ͨ���ʵ�������O2�������SO2��������
��4����
��5��ʹװ���ڵ�ѹǿά����һ����Χ����ֹ�ҡ���װ���ڵ�Һ�嵹��������������Ҳ�ɣ�
��6��ȱ��β������װ�ã�Ӧ���ڱ�����������ʢ���ռ���Һ��ϴ��ƿ
����:��1������ѧ���Է�Ӧԭ�������ա�
��2������װ��ͼ��֪��������ʹSO2��O2�ڴ��������·���������Ӧ�����Լ���Ӵ���������ͬ������װ��Ũ����Ӧ��������������ͬ��
��3�����ݷ�Ӧԭ����֪�����������ɼ�Ŀ��������SO2��ת���ʡ�
��4��������Ϊˮ������SO3�����գ��ײ���������
��5��ʹװ���ڵ�ѹǿά����һ����Χ����ֹ�ҡ���װ���ڵ�Һ�嵹������ȫƿ�����á�
��6��ȱ��β������װ�ã�Ӧ���ڱ�����������ʢ ���ռ���Һ��ϴ��ƿ��������Ⱦ������



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
| ���ջ�ԭ |
| ˮ��ȡ |
| ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
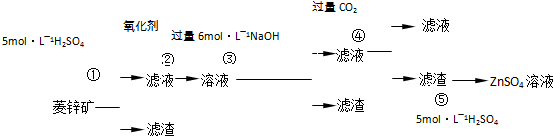
 ��2009?����ģ�⣩����ݹ�ҵ��������й�֪ʶ�ش��������⣺
��2009?����ģ�⣩����ݹ�ҵ��������й�֪ʶ�ش��������⣺
| ||
| ||
| ||
| �� |


�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ||

| ||
| ||
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013-2014ѧ��㶫ʡ����У�����������������ۻ�ѧ�Ծ��������棩 ���ͣ������
�Ի�����Ϊԭ��������������������к�Fe2O3��SiO2��Al2O3��MgO�ȡ�ʵ����ģ�ҵ���������Ʊ�����(Fe2O3)���������£�

��1���������ijɷ�������������������� �� д�����ܹ���Fe2O3��ϡ���ᷴӦ�����ӷ�Ӧ����ʽ�� ��
��2�����������У�Ϊ��ȷ������Ĵ��ȣ�����������Ҫ������Һ��pH�ķ�Χ��_________��������������������������ʽ����ʱ��Һ��pH���±���
|
������ |
Fe(OH)3 |
Al(OH)3 |
Fe(OH)2 |
Mg(OH)2 |
|
��ʼ���� |
2.7 |
3.8 |
7.5 |
9.4 |
|
��ȫ���� |
3.2 |
5.2 |
9.7 |
12.4 |
��3������A����Ҫ�ɷ�Ϊ ����ҺB���Ի��յ�������______________________��
��4������ϴ�ӹ��̵�ʵ����� ��
��5����֪����������Ϊw kg�����������Ʊ������У���Ԫ�����25%�����յõ����������Ϊm kg����ԭ������������Ԫ����������Ϊ ��������������ʽ��ʾ����
����֪���ԭ��������O 16 S 32 Fe 56 ��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com