
【题目】下列各组物质熔点高低的比较,正确的是( )
A. 晶体硅>金刚石>碳化硅B. ![]()
C. ![]() D.
D. ![]()
【答案】C
【解析】
A.晶体硅、金刚石、碳化硅都是原子晶体,因键长C-C<C-Si<Si-Si,原子晶体中半径越小,共价键越强,熔点越大,则熔点为金刚石>碳化硅>晶体硅,A错误;
B.这几种都是离子晶体,阴离子相同,离子半径Cs+>K+>Na+,晶格能CsCl<KCl<NaCl,物质的晶格能越大,熔沸点越高,所以晶体熔点CsCl<KCl<NaCl,B错误;
C.二氧化硅是原子晶体,原子间通过共价键结合,二氧化碳是分子晶体,CO2分子之间通过分子间作用力结合,He是分子晶体,He分子之间通过分子间作用力结合,二氧化碳相对分子质量大于He,分子间作用力越大,物质的熔沸点越高,化学键比分子间作用力大很多,所以晶体熔点SiO2>CO2>He,C正确;
D.Cl2、Br2、I2都是分子晶体,物质的分子的相对分子质量越大,分子间作用力就越强,物质的熔沸点就越高,由于相对分子质量I2>Br2>Cl2,所以这三种物质熔点高低顺序是I2>Br2>Cl2,D错误;
故合理选项是C。


 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案科目:高中化学 来源: 题型:
【题目】下列关于氧化铝和氢氧化铝的叙述错误的是( )
A. Al(OH)3受热能分解
B. Al2O3既能溶于强酸溶液又能溶于强碱溶液
C. Al(OH)3胶体能吸附水中的悬浮物
D. Al(OH)3与过量的浓氨水反应生成NH4[Al(OH)4]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】BHT是一种常用的食品抗氧化剂。由对甲基苯酚(![]() )合成BHT的常用方法有2种(如图)。下列说法中,不正确的是
)合成BHT的常用方法有2种(如图)。下列说法中,不正确的是
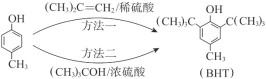
A. BHT能使酸性KMnO4溶液褪色
B. BHT与对甲基苯酚互为同系物
C. BHT与FeCl3溶液不发生显色反应
D. 方法一的原子利用率高于方法二
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,装置(Ⅰ)是一种可充电电池的示意图,装置(Ⅱ)为电解池的示意图;装置(Ⅰ)的离子交换膜只允许![]() 通过。电池放电的化学方程式为
通过。电池放电的化学方程式为![]() 。当闭合K时,X极附近溶液先变红色。下列说法正确的是( )
。当闭合K时,X极附近溶液先变红色。下列说法正确的是( )
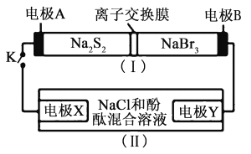
A.装置(Ⅰ)中A为正极
B.电极X的电极溶液变红的原因![]()
C.放电时,电极B的电极反应式为![]()
D.给原电池充电时![]() 从右向左通过离子交换膜
从右向左通过离子交换膜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表共有18个纵行,从左到右排为1~18列,即碱金属是第一列,稀有气体是第18列。按这种规定,下面说法正确的是( )
A. 最外层电子数为ns2的元素都在第2列
B. 第5列元素的原子最外层电子的排布式为![]()
C. 第10、11列为ds区的元素
D. 形成化合物种类最多的元素在第14列,属于P区的元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关晶体的叙述中正确的是( )
A.在SiO2晶体中,由Si、O构成的最小单元环中共有8个原子
B.在28g晶体硅中,含Si﹣Si共价键个数为4NA
C.金刚石的熔沸点高于晶体硅,是因为C﹣C键键能小于Si﹣Si键
D.镁型和铜型金属晶体的配位数均为12
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年诺贝尔化学奖颁给锂离子电池领域,获奖科学家的重要贡献之一是研发出了电极材料——磷酸亚铁锂(LiFePO4)。LiFePO4的一种制备方法如图。
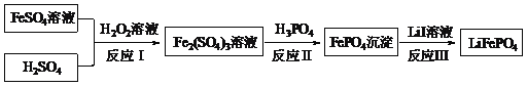
下列说法正确的是( )
A.过氧化氢的电子式为:![]()
B.反应Ⅰ的离子方程式为:2Fe2++H2O2=2Fe3++2OH-
C.反应Ⅱ的离子方程式为:Fe3++PO![]() =FePO4↓
=FePO4↓
D.反应Ⅲ的化学方程可能为:2FePO4+2LiI=2LiFePO4+I2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】双氧水是一种重要的氧化剂、漂白剂和消毒剂。生产双氧水常采用蒽醌法,其反应原理和生产流程如图所示:
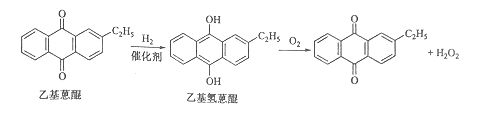
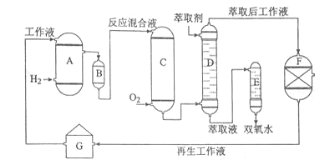
A.氢化釜 B.过滤器 C.氧化塔 D.萃取塔 E..净化塔 F.工作液再生装置 G.工作液配制装置
生产过程中,把乙基蒽醌溶于有机溶剂配制成工作液,在一定的温度、压力和催化剂作用下进行氢化,再经氧化、萃取、净化等工艺得到双氧水。回答下列问题:
(1)蒽醌法制备双氧水理论上消耗的原料是_______,循环使用的原料是______,配制工作液时采用有机溶剂而不采用水的原因是______。
(2)氢化釜A中反应的化学方程式为_______,进入氧化塔C的反应混合液中的主要溶质为_______。
(3)萃取塔D中的萃取剂是____,选择其作萃取剂的原因是______。
(4)工作液再生装置F中要除净残留的H2O2,原因是______。
(5)双氧水浓度可在酸性条件下用KMnO4溶液测定,该反应的离子方程式为_______。一种双氧水的质量分数为27.5%,(密度为1.10g·cm3),其浓度为______mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:① X、Y、Z、W、R、Q为原子序数依次增大的短周期元素。X 是所有元素中原子半径最小的元素,Y是形成化合物种类最多的元素,W的最外层电子数是次外层电子数的3倍,Q与W同主族,Y、R原子的最外层电子数之和等于Z的最外层电子数。
②莱纳斯·卡尔·鲍林在1932年提出electronegativity作为元素原子在化合物某种性质的标度,electronegativity的大小可以判断元素金属性与非金属性强弱,下表列出部分短周期元素的Electronegativity的值。
元素 | X | Y | Z | W | R | Q |
electronegativity | 2.1 | 2.5 | 3.0 | 3.5 | 0.9 | 2.5 |
元素 | Mg | Li | Al | Cl | P | Be |
electronegativity | 1.2 | 1.0 | 1.5 | 3.0 | 2.1 | 1.5 |
请回答下列问题(涉及X、Y、Z、W、R、Q时,用元素符号表示):
(1)根据上表给出的数据,可知元素的electronegativity越大,__(填“金属性”或“非金属性”)越强。
(2)元素Q在周期表中的位置为_________。
(3)W、R、Q单核简单离子半径由大到小排列顺序为______。
(4)元素X、Z、W之间能形成多种10电子微粒,请写出反应物和产物均为X、Z、W之间形成的10电子微粒的一个离子方程式______________。
(5)一种由元素W、R组成的白色固体化合物,其电子式为_______________。
(6)试比较稳定性:X2W_____ X2Q;沸点:X2W_____ X2Q (填“<”或“>”)。
(7)元素 X、Y、Z、W、R、Q中的两种元素可形成原子个数比为1∶2的共价化合物,则这两种元素的原子序数之差不可能是_________。
A.2 B.4 C.5 D.7
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com