

分析 (1)已知①N2(g)+2O2(g)═N2O4(l),△H=-19.5kJ/mol;
②N2H4(l)+O2(g)═N2(g)+2H2O(l),△H=-622.0kJ/mol;
③H2O(g)=H2O(l)△H=-44.0kJ/mol;
利用盖斯定律将②×2-①-③×4可得2N2H4(l)+N2O4(g)═3N2(g)+4H2O(g),并以此计算反应热;
(2)①c(NO2)越大,颜色越深;根据图中的数据计算出平衡时各物质的浓度,再计算平衡常数;
②D点要达平衡,必须降低N2O4的百分含量,也就是逆向建立平衡,E点要到达平衡,必须升高N2O4的百分含量,正向建立平衡,A、B、C三点都在平衡线上,所以此三点的正逆反应速率相等;
温度越高反应速率越大,反应达到平衡时间越短;
(3)根据图3t1时刻改变条件后v(正)瞬间增大,v(逆)减小,v(正)<v(逆),则平衡一定正向移动,据此分析;
(4)该反应是一个反应前后气体体积增大的且是正反应是吸热的化学反应,t2时逆反应速率增大,且平衡时反应速率大于t2时反应速率,平衡向逆反应方向移动,t8时反应速率增大,但平衡不移动,根据外界条件对化学反应速率的影响来分析解答.
解答 解:(1)已知①N2(g)+2O2(g)═N2O4(l),△H=-19.5kJ/mol;
②N2H4(l)+O2(g)═N2(g)+2H2O(l),△H=-622.0kJ/mol;
③H2O(g)=H2O(l)△H=-44.0kJ/mol;
利用盖斯定律将②×2-①-③×4可得2N2H4(l)+N2O4(g)═3N2(g)+4H2O(g)△H=-1048.5kJ/mol,
故答案为:N2O4(l)+2N2H4(l)=3N2(g)+4H2O(g)△H=-1048.5kJ/mol;
(2)①从a到b,c(NO2)增大,c点和d点分别是增大c(NO2)后未达到平衡的点和平衡时的点,所以c点c(NO2)大于d点,二氧化氮浓度越大颜色越深,故颜色由深到浅的顺序是?c>d>b>a,由题图可知,平衡时c(NO2)=0.6mol•L-1,c(N2O4)=0.4mol•L-1,故该温度下该反应的平衡常数K=$\frac{0.4}{0.{6}^{2}}$=1.11,
故答案为:?c>d>b>a;1.11;
②A、B、C三点都在平衡线上,所以此三点的正逆反应速率相等,D点要达平衡,必须降低N2O4的百分含量,也就是逆向建立平衡,从而得出v(正)<v(逆),E点要达平衡,必须提高N2O4的百分含量,也就是正向建立平衡,从而得出v(正)>v(逆);
温度越高反应速率越大,反应达到平衡时间越短,因为t1<t2,所以x>y,
故答案为:D;>;
(3)根据图3t1时刻改变条件后v(正)瞬间增大,v(逆)减小,v(正)<v(逆),则平衡一定正向移动,故A正确;
故答案为:A;
(4)t1到t6平衡都逆向移动,而t6时平衡正向移动,是因为增加反应物的浓度,而C是固体,所以是增加水蒸气的量,所以本身的转化率降低,t8时反应速率增大,但平衡不移动,故平衡转化率最低t7-t8 (或“t7到t8”),t4时刻速率都比原来速率小,平衡逆向,所以是降低温度,
故答案为:t7-t8;降低温度.
点评 本题综合考查了盖斯定律的应用、化学平衡和化学反应速率等知识,题目难度中等,题目涉及盖斯定律在计算中的应用、影响反应速率的因素、化学平衡的影响因素和平衡常数的计算等,做题时注意把握影响平衡移动的因素以及平衡常数的有关计算,此为化学平衡常考查问题.


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:选择题
| A. | H2SO4与K2CO3;HNO3与Na2CO3 | B. | CH3COOH与KOH;HCl与NaOH | ||
| C. | BaCl2与Na2SO4;Ba(OH)2与(NH4)2SO4 | D. | HCl与Na2CO3;HCl与NaHCO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| Fe2O3 | CO | Fe | CO2 | |
| 甲/mol | 1.0 | 1.0 | 1.0 | 1.0 |
| 乙/mol | 1.0 | 1.5 | 1.0 | 1.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
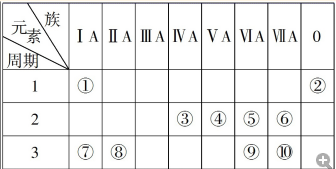
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
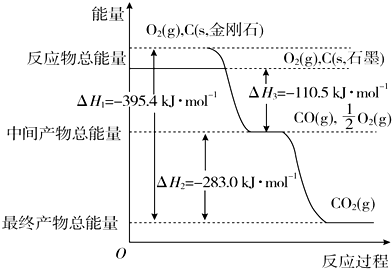
| 化学式 | H2(g) | CO(g) | CH3OH(l) |
| 标准燃烧热(25℃) △H/kJ•mol-1 | -285.8 | -283.0 | -726.5 |

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
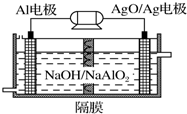 铝是地壳中含量最高的金属元素,其单质及合金在生产生活中的应用日趋广泛.
铝是地壳中含量最高的金属元素,其单质及合金在生产生活中的应用日趋广泛.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在常温下,放热反应一般能自发进行,吸热反应都不能自发进行 | |
| B. | NH4HCO3(s)=NH3(g)+H2O(g)+CO2(g)△H=+185.57kJ/mol,能自发进行,原因是体系有自发地向混乱度增加的方向转变的倾向 | |
| C. | 氯化钴溶液中存在平衡: [Co(H2O)6]2+(粉红色)+4Cl-?[CoCl4]2-(蓝色)+6H2O;△H=akJ•mol-1,将氯化钴溶液置于冰水浴中,溶液变成粉红色,则可知:a<0 | |
| D. | 用容量瓶配制一定物质的量浓度的溶液,定容时俯视刻度线,所配溶液浓度偏小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验室配制的亚铁盐溶液在空气中被氧化:4Fe2++O2+2H2O═4Fe3++4OH- | |
| B. | 以金属银为阳极电解饱和硫酸铜溶液:Cu2++2H2O$\frac{\underline{\;通电\;}}{\;}$2Cu+O2↑+4H+ | |
| C. | Ca(ClO)2溶液中通入过量的SO2气体:ClO-+SO2+H2O═HClO+HSO3- | |
| D. | 用酸化的高锰酸钾溶液氧化双氧水:2 MnO4-+6H++5H2O2═2Mn2++5O2↑+8H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com