
| A、该烷烃的物质的量为(b-a)mol |
| B、该烷烃的物质的量为a mol |
| C、该烷烃的物质的量为(b-a)/2 mol |
| D、不能求出该烷烃的物质的量 |
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 溶液Y中铝元素的存在形式 | 溶液X中 | ||
| 一定存在的离子 | 一定不存在的离子 | 不能确定的离子 | |
| Al3+ | |||
| Cl- | |||
查看答案和解析>>
科目:高中化学 来源: 题型:
| c(Cl-) |
| c(ClO-) |
A、若某温度下,反应后C(Cl-):C(ClO-)=11,则溶液中C(ClO-):C(ClO3-)=
| ||||
B、参加反应的氯气的物质的量等于
| ||||
C、改变温度,反应中转移电子的物质的量n的范围:
| ||||
D、改变温度,产物中KC1O3的最大理论产量为
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、加入Al粉放出H2的溶液中:Na+、K+、Fe3+、NO3- |
| B、c(Fe3+)=0.1mol/L的溶液中:NH4+、AlO2-、SO42-、HCO3- |
| C、水电离出的c(H+)=1×10-13mol/L的溶液中:Mg2+、K+、NO3-、Cl- |
| D、c(H+)=1×10-13mol/L的溶液中:K+、Cl-、AlO2-、CO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
235 92 |
235 92 |
A、
| ||||
B、
| ||||
C、
| ||||
D、
|
查看答案和解析>>
科目:高中化学 来源: 题型:
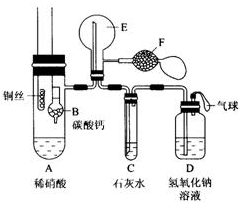 为了证明铜与稀硝酸反应产生一氧化氮,某校学生实验小组设计了一个实验,其装置如图所示(加热装置和固定装置均已略去).B为一个用金属丝固定的干燥管,内装块状碳酸钙固体;E为 一个空的蒸馏烧瓶;F是用于鼓入空气的双连打气球.
为了证明铜与稀硝酸反应产生一氧化氮,某校学生实验小组设计了一个实验,其装置如图所示(加热装置和固定装置均已略去).B为一个用金属丝固定的干燥管,内装块状碳酸钙固体;E为 一个空的蒸馏烧瓶;F是用于鼓入空气的双连打气球. 查看答案和解析>>
科目:高中化学 来源: 题型:
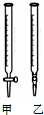 某学生用0.1000mol?L-1标准NaOH溶液滴定未知浓度的盐酸,其操作可分解为以下几步:
某学生用0.1000mol?L-1标准NaOH溶液滴定未知浓度的盐酸,其操作可分解为以下几步:| 滴定次数 | 待测溶液的体积(/mL) | 标准NaOH溶液的体积 | |
| 滴定前读数(/mL) | 滴定后读数(/mL) | ||
| 1 | 25.00 | 1.02 | 21.03 |
| 2 | 25.00 | 2.00 | 21.99 |
| 3 | 25.00 | 0.20 | 20.20 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com