
【题目】25℃时,NaOH和Na2CO3两溶液的pH均为12.两溶液中,由水电离出的c(H+)分别是、 .
科目:高中化学 来源: 题型:
【题目】对于可逆反应N2(g)+3H2(g)2NH3(g),下列措施能使反应物中活化分子百分数和化学平衡常数都变化的是( )
A.增大压强
B.充入更多N2
C.使用高效催化剂
D.降低温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知H2(g)+ ![]() O2(g)═H2O(g)△H=﹣241.8kJmol﹣1 . 下列说法中不正确的是( )
O2(g)═H2O(g)△H=﹣241.8kJmol﹣1 . 下列说法中不正确的是( )
A.H2的燃烧热为241.8 kJmol﹣1
B.2H2(g)+O2(g)═2H2O(g)△H=﹣483.6 kJmol﹣1
C.1 mol H2完全燃烧生成液态水放出的热量大于241.8 kJ
D.断开1 mol H2O的化学键吸收的总能量大于断裂1 mol H2和0.5 mol O2的化学键所吸收的总能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于胶体的说法不正确的是 ( )
A. 制备Fe(OH)3胶体后可以用渗析的方法净化
B. 利用丁达尔效应可以区分溶液和胶体
C. 电泳现象可证明胶体都带电
D. 胶体是分散质粒子直径在1 nm~100 nm之间的分散系
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图所示。下列说法不正确的是
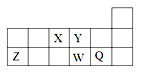
A. 离子半径的大小顺序为:r(W2-)>r(Q-)>r(Y2-)>r(Z3+)
B. 元素W的最高价氧化物对应水化物的酸性比Q的强
C. 元素X的氢化物与Q的氢化物化合的产物中既含共价键又含离子键
D. X、Z、W、Q四种元素的最高价氧化物对应水化物均能与强碱反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外小组研究铝土矿中Al2O3的含量。已知铝土矿的主要成分是Al2O3,杂质有Fe2O3、SiO2等。从铝土矿中提取Al2O3的流程如下:
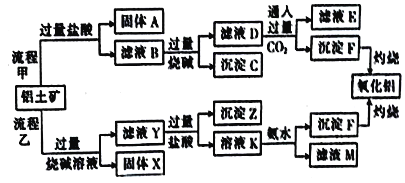
(1)固体A是_______________(填化学式)。
(2)流程甲中加入盐酸后生成Fe3+的离子方程式为___________________________。
(3)沉淀F转化为氧化铝的化学方程式是________________________________。
(4)流程乙中,由溶液K生成沉淀F的离子方程式是________________________________。
(5)工业上用Al2O3与C、Cl2在高温条件下反应制取AlCl3,每消耗0.5mol碳单质,转移1mol电子,该反应的化学方程式是_____________________。
(6)流程乙中,将实验过程中所得固体精确称量,课外小组发现所得氢氧化铝固体的质量与原铝土矿质量相等,则该铅土矿中Al2O3的质量分数是______(保留一位小数,可能用到的相对原子质量:H-1,O-16,A1-27)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关物质的转化关系如图所示(部分物质与条件已略去).A、C、E、G是 中学化学中常见的单质:通常状况下,E是密度最小的气体,G是黄绿色的气体,B 是常见的无色液体,F为强碱,D是某种具有磁性的金属矿物的主要成分,K受热分解可生成红棕色固体. 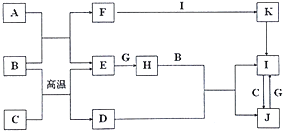
请回答下列问题:
(1)D的化学式为
(2)H的电子式为
(3)写出A与B反应的化学方程式:
(4)写出常温下G与F的溶液反应的离子方程式: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于化学与生产、生活的认识正确的是
A. 绿色食品就是不使用化肥农药,不含任何化学物质的食品
B. 用Ba(OH)2处理含Cu2+的废水,可消除水中重金属离子的污染
C. 煤经过气化和液化等物理变化可转化为清洁燃料
D. ![]() 和CO2生成可降解聚合物
和CO2生成可降解聚合物 ,反应符合绿色化学的原则
,反应符合绿色化学的原则
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com