
| A. | 实验室中少量金属钠通常保存在煤油中 | |
| B. | 光线通过时,胶体可产生丁达尔效应 | |
| C. | 氧气、液氯是单质,氯水、氯化氢、纯碱是化合物. | |
| D. | “只要工夫深,铁杵磨成针”只涉及物理变化 |
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 物质 | 粒子数(个) | 质量(g) | 物质的量(mol) | 摩尔质量(g/mol) |
| 氦气 | 0.3 | |||
| S | 1.204×1023 | |||
| CO2 | 22 | |||
| C12H22O11 | 0.25 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.3 g Na和足量的O2完全反应,生成3.4g固体混合物,转移电子数为0.1NA | |
| B. | 电解精炼铜时,当阳极减少64g金属时转移的电子数为2NA | |
| C. | 46 g的NO2与46 g的N2O4含有的原子数不同 | |
| D. | 标准状况下,11.2 L苯中含有碳碳双键数目为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 电离常数 酸 | K1 | K2 |
| H2SO3 | 1.3×10-2 | 6.3×10-8 |
| H2CO3 | 4.2×10-7 | 5.6×10-11 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,反应4Fe(OH)2(s)+2H2O(l)+O2(g)═4Fe(OH)3(s)能自发进行,则△H<0 | |
| B. | 铁片镀锌时,铁片与外电源的正极相连 | |
| C. | 以熔融Al2O3为电解质进行电解冶炼铝,熔融体中Al3+向阳极移动 | |
| D. | t℃时,恒容密闭容器中反应:NO2(g)+SO2(g)?NO(g)+SO3(g),通入少量O2,$\frac{c(NO).c(S{O}_{3})}{c(N{O}_{2}).c(S{O}_{2})}$的值及SO2转化率不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
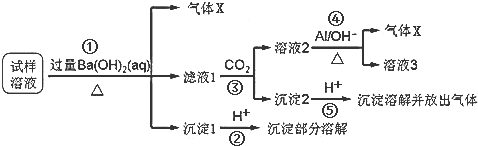
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com