
下列有关水电离情况的说法正确的是
A.25℃,pH=12的烧碱溶液与纯碱溶液,水的电离程度相同
B.其它条件不变,稀释醋酸钠溶液,水的电离程度增大
C.其它条件不变,稀释氢氧化钠溶液,水的电离程度减小
D.其它条件不变,温度升高,水的电离程度增大,Kw增大
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:2015-2016学年湖北省枣阳市高一上学期期中考试化学试卷(解析版) 题型:选择题
NA为阿伏加德罗常数,下列有关说法中不正确的是
A.标准状况下,22.4 L氦气含有NA个氦原子
B.20 g重水含有10 NA个电子
C.12.5 mL l6 mol·L-1浓硫酸与足量铜反应,转移电子数为0.2 NA
D.1.6 g由氧气和臭 氧组成的混合物中含有氧原子的数目为0.1 NA
氧组成的混合物中含有氧原子的数目为0.1 NA
查看答案和解析>>
科目:高中化学 来源:2016届福建省高三上学期半期考试化学试卷(解析版) 题型:填空题
铁及其化合物在日常生活中应用广泛,请根据下列实验回答问题:
(1)钢铁在潮湿的空气中发生吸氧腐蚀的正极反应式为 。
(2)生铁中含有一种铁碳化合物X(Fe3C),X在足量的空气中高温煅烧,生成有磁性氧化物Y,Y可溶于过量盐酸,形成黄绿色的溶液,写出Y与盐酸反应的化学方程式 。
(3)某炼铁废渣中含有大量CuS及少量铁的化合物,工业上以该废渣为原料生产CuCl2·H2O的工艺流程如下:
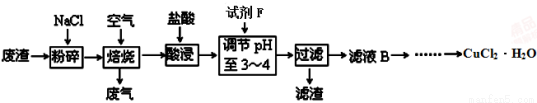
已知:Fe(OH)2、Fe(OH)3、Cu(OH)2沉淀完全时的pH值分别为9.7、3.3、6.4。
试回答下列问题:
①试剂F应选用 (填编号)。
A.Cl2 B.NaClO C.HNO3 D.浓硫酸
理由是 。
②为了获得晶体,对滤液B进行的操作是蒸发浓缩,趁热过滤,滤液经冷却结晶,过滤得到产品。分析有关物质的溶解度曲线(如图),“趁热过滤”得到的固体是 。

查看答案和解析>>
科目:高中化学 来源:2016届贵州省高三上半期考试理综化学试卷(解析版) 题型:选择题
某课外兴趣小组进行电解原理的实验探究,做了如下的实验:以铜为电极,按如图所示的装置电解饱和食盐水。

实验现象:接通电源30 s内,阳极附近出现白色浑浊,之后变成橙黄色浑浊,此时测定溶液的pH约为10。一段时间后,试管底部聚集大量红色沉淀,溶液仍为无色。
查阅资料:
物质 | 氯化铜 | 氧化亚铜 | 氢氧化亚铜(不稳定) | 氯化亚铜 |
颜色 | 固体呈棕色,浓溶液呈绿色,稀溶液呈蓝色 | 红色 | 橙黄色 | 白色 |
*相同温度下CuCl的溶解度大于CuOH
下列说法错误的是
A.反应结束后最终溶液呈碱性
B.阴极上发生的电极反应为:2H2O + 2e? ═ H2↑+ 2OH?
C.电解过程中氯离子移向阳极
D.试管底部红色的固体具有还原性
查看答案和解析>>
科目:高中化学 来源:2016届黑龙江省高三上学期第二次检测化学试卷(解析版) 题型:实验题
醋酸是日常生活中常见的弱酸。
I.常温下在pH=5的醋酸稀溶液中,醋酸电离出的c(H+)的精确值是 mol·L-1。
II.某同学用0.100 0 mol·L-1 NaOH溶液滴定20.00 mL某浓度的CH3COOH溶液
(1)部分操作如下:
①取一支用蒸馏水洗净的碱式滴定管,加入标准氢氧化钠溶液,记录初始读数
②用酸式滴定管放出一定量待测液,置于用蒸馏水洗净的锥形瓶中,加入2滴甲基橙
③滴定时,边滴加边振荡,同时注视滴定管内液面的变化
请选出上述操作过程中存在错误的序号_________________。上述实验与一定物质的量浓度溶液配制实验中用到的相同仪器__________________。
(2)某次滴定前滴定管液面如图所示,读数为________mL。
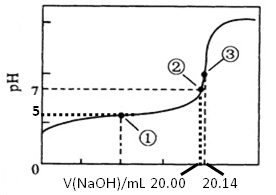
(3)根据正确实验结果所绘制的滴定曲线如上图所示,其中点①所示溶液中c(CH3COO-)=1.7c(CH3COOH),点③所示溶液中c(CH3COO-)+c(CH3COOH)=c(Na+)。计算醋酸的电离常数___________,该CH3COOH的物质的量浓度为__________ mol•L—1。
查看答案和解析>>
科目:高中化学 来源:2016届黑龙江省高三上学期第二次检测化学试卷(解析版) 题型:选择题
下列有关说法正确的是
A.反应NH3(g)+HCl(g)=NH4Cl(s)在室温下可自发进行,则该反应的△H>0
B.电解法精炼铜时,以粗铜作阴极,纯铜作阳极
C.CH3COOH 溶液加水稀释后,溶液中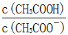 的值减小
的值减小
D.增大反应物浓度可加快反应速率,因此用浓硫酸与铁反应能增大生成H2的速率
查看答案和解析>>
科目:高中化学 来源:2016届辽宁省高三上学期期中测试化学试卷(解析版) 题型:推断题
(I)A、B、C、D均为中学化学常见的纯净物,A是单质。它们之间有如下的反应关系:
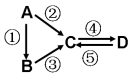
(1)若B是淡黄色固体,②③反应均用到同一种液态氢化物。D物质常用于食品工业。写出④反应的化学方程式___________________________。
(2)若B是气态氢化物。C、D是氧化物且会造成光化学烟雾污染。写出③反应的化学方程式______________。
(3)若D物质具有两性,②③反应均要用强碱溶液,④反应是通入过量的一种引起温室效应的主要气体。写出④反应离子方程式________________________。
(4)若A是太阳能电池用的光伏材料。C、D为钠盐,两种物质中钠、氧外的元素为同一主族,且溶液均显碱性。写出②反应的化学方程式________________________。
(5)若A是应用最广泛的金属。④反应用到A,②⑤反应均用到同一种非金属单质。写出④反应的离子方程式______________________________________________。
(II)在温度相同、体积均为1 L的三个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下。已知:2SO2(g)+O2(g) 2SO3(g) ΔH =-98.3 kJ·mol-1。
2SO3(g) ΔH =-98.3 kJ·mol-1。
容 器 | 甲 | 乙 | 丙 |
反应物投入量 | 2 mol SO2、1 mol O2 | 2 mol SO3 | m mol SO2、n mol O2、p mol SO3 |
c(SO3) /mol·L-1 | 1.4 | 1.4 | 1.4 |
能量变化 | 放出a kJ | 吸收b kJ | 吸收c kJ |
SO2或SO3的转化率 | α1 | α2 | 12.5% |
则:α1+α2=_________________,p=________________mol,b+c=_______________kJ 。
(III)HA、H2B、H3C三种弱酸,根据“较强酸+较弱酸盐 较强酸盐+较弱酸”的反应规律,它们之间能发生下列反应:A.HA+HC2-(少量)
较强酸盐+较弱酸”的反应规律,它们之间能发生下列反应:A.HA+HC2-(少量) A-+H2C- B.H2B(少量)+2A-
A-+H2C- B.H2B(少量)+2A- B2-+2HA
B2-+2HA
C.H2B(少量)+H2C- HB-+H3C
HB-+H3C
回答下列问题:
(1)相同条件下,HA、H2B、H3C三种酸中,酸性最强的是_____________。
(2)A-、B2-、C3-、HB-、H2C-、HC2-六种离子中,最易结合质子(H+)的是_________,最难结合质子的是____________。
(3)完成下列反应的离子方程式HA(过量)+C3-:________________________________。
(IV)在25下,将a mol/L的氨水与0.01 mol/L的盐酸等体积混合,反应平衡时溶液中c(NH4+) = c(Cl-),则溶液显______________(填“酸”、“碱”或“中”)性;用含a的代数式表示NH3·H2O的电离常数Kb=_____________。
查看答案和解析>>
科目:高中化学 来源:2016届山东省高三上学期第二次诊断测试化学试卷(解析版) 题型:实验题
有一含NaCl、Na2CO3·10H2O和NaHCO3的混合物,某同学设计如下实验,通过测量反应前后C、D装置质量的变化,测定该混合物中各组分的质量分数。
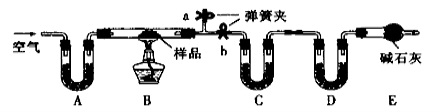
(1)加热前通入空气的目的是 。
(2)装置C、D中盛放的试剂为C ,D 。
(3)若将A装置换成盛放NaOH溶液的洗气瓶,则测得的NaCl含量将 (填“偏高”、“偏低”或“无影响”,下同);若B中反应管右侧有水蒸气冷凝,则测定结果中NaHCO3的含量将 ;若撤去E装置,则测得Na2CO3·10H2O的含量将 。
(4)若样品的质量为25.0g,反应后C、D的质量差分别为9.9g、2.2g,由此可知混合物中NaHCO3的质量分数为 。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年贵州遵义航天中学高二上第三次月考化学卷(解析版) 题型:?????
下列溶液中微粒浓度关系一定正确的是( )
A.氨水与氯化铵的pH=7的混合溶液中:c(Cl-)>c(NH)
B.pH=2的一元酸和pH=12的一元强碱等体积混合:c(OH-)=c(H+)
C.0.1 mol·L-1的硫酸铵溶液中:c(NH4+)>c(SO42-)>c(H+)
D.0.1 mol·L-1的硫化钠溶液中:c(OH-)=c(H+)+c(HS-)+c(H2S)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com