
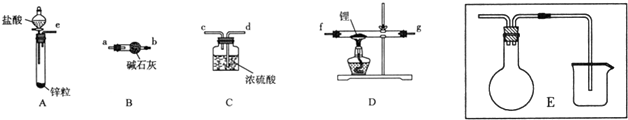
分析 (1)氢气和锂发生反应生成LiH,制备LiH固体需要制备氢气,LiH在干燥的空气中能稳定存在,遇水或酸能够引起燃烧,所以制备得到的氢气必须干燥纯净,利用A装置制备氢气,用装置B中的碱石灰除去氢气中的氯化氢和水蒸气,通入装置D中加热和锂反应生成氢化锂,最后连接装置C,防止空气中的水蒸气和二氧化碳进入装置D和生成的氢化锂发生反应;制备气体装置,加入药品前首先要进行的实验操作是:检验装置气密性;
(2)石蜡是有机物,易溶解于有机溶剂甲苯;
(3)使用前应通入一段时间氢气,排尽装置内的空气,防止加热时氢气不纯发生爆炸危险;
(4)LiH与H2O发生水解反应,锂离子结合氢氧根离子,氢负离子与氢离子结构生成氢气,LiH与乙醇反应类似,羟基提供H原子与LiH反应生成氢气,另外部分结合生成CH3CH2OLi;
(5)设LiH与Li的物质的量分别为xmol、ymol,根据方程式表示出生成氢气的物质的量,再根据二者总质量、氢气总体积列方程计算解答;
(6)装置E用来收集H2,利用的是在烧瓶中收集氢气,所以根据排水量气法设计装置,导气管短进长出.
解答 解:(1)氢气和锂发生反应生成LiH,制备LiH固体需要制备氢气,LiH在干燥的空气中能稳定存在,遇水或酸能够引起燃烧,所以制备得到的氢气必须干燥纯净,利用A装置制备氢气,用装置B中的碱石灰除去氢气中的氯化氢和水蒸气,通入装置D中加热和锂反应生成氢化锂,最后连接装置C,防止空气中的水蒸气和二氧化碳进入装置D和生成的氢化锂发生反应,装置连接顺序为:eabfgdc;制备气体装置,加入药品前首先要进行的实验操作是:检验装置气密性;装置B中碱石灰是氧化钙和氢氧化钠的混合物,氧化钙与水可反应,氢氧化钠可作干燥剂,且与盐酸能反应,所以该装置的作用是吸收水蒸气和部分氯化氢气体,
故答案为:eabfgdc;检验装置气密性;除去H2中的H2O和HCl;
(2)取出一定量金属锂(固体石蜡密封),然后在甲苯中浸洗数次,利用石蜡是有机物易溶解于有机溶剂甲苯中,操作的目的是除去锂表面的石蜡,
故答案为:除去锂表面的石蜡;
(3)使用前应通入一段时间氢气,排尽装置内的空气,防止加热时氢气不纯发生爆炸危险,在加热D处的石英管之前,必须进行的实验操作是:收集c处排出的气体并检验H2纯度,
故答案为:收集c处排出的气体并检验H2纯度;
(4)LiH与H2O发生水解反应,锂离子结合氢氧根离子,氢负离子与氢离子结构生成氢气,LiH与乙醇反应类似,羟基提供H原子与LiH反应生成氢气,另外部分结合生成CH3CH2OLi,反应方程式为:LiH+CH3CH2OH=CH3CH2OLi+H2↑,
故答案为:LiH+CH3CH2OH=CH3CH2OLi+H2↑;
(5)设LiH与Li的物质的量分别为xmol、ymol,则:
LiH+H2O=H2↑+LiOH
xmol xmol
2Li+2H2O=2LiOH+H2↑
ymol 0.5y mol
则8x+7y=0.174,22.4(x+0.5y)=0.4704,
解得x=0.02、y=0.002
故LiH与Li的物质的量之比为0.02mol:0.002mol=10:1,
故答案为:10:1;
(6)装置E用来收集H2,利用的是在烧瓶中收集氢气,所以根据排水量气法设计装置,导气管短进长出,装置图为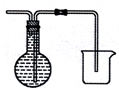 ,故答案为:
,故答案为: .
.
点评 本题考查化学实验制备方案,理解原理是解题关键,涉及对装置及操作的分析评价、气体收集、化学方程式的计算等,题目难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
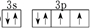
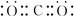
 ,该电子排布图错误的理由是违背了洪特规则.
,该电子排布图错误的理由是违背了洪特规则.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
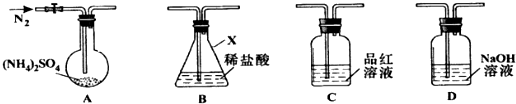
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
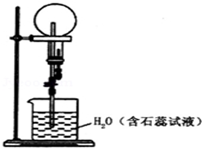 已知NH3和HCl都能用来作喷泉实验的气体,若在相同条件下用等体积烧瓶各收集满NH3和HCl气体,进行实验(两烧瓶内充满溶液且不考虑溶质的扩散).下列说法正确的是( )
已知NH3和HCl都能用来作喷泉实验的气体,若在相同条件下用等体积烧瓶各收集满NH3和HCl气体,进行实验(两烧瓶内充满溶液且不考虑溶质的扩散).下列说法正确的是( )| A. | NH3和HCl分别形成红色、蓝色喷泉 | |
| B. | 制备干燥的NH3和HCl,可分别用无水CaCl2、碱石灰干燥 | |
| C. | 改为NO2气体,所得溶液溶质的物质的量浓度与前两者不同 | |
| D. | 去掉装置中的胶头滴管,改为单孔塞,也可引发喷泉 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用10mL量筒量取7.13mL稀盐酸 | |
| B. | 用碱式滴定管量取15.20 ml 酸性高锰酸钾溶液 | |
| C. | 配制氯化铁溶液时,把氯化铁溶解在一定浓度的盐酸中,再加水稀释 | |
| D. | 用带有橡胶塞的玻璃试剂瓶盛放NaF溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com