
【题目】下列实验操作中会导致结果偏高的是 ( )
① 配制稀H2SO4时,洗涤量取浓H2SO4后的量筒,并将洗涤液转移到容量瓶中
② 配制溶液时,未等稀释后的H2SO4溶液冷却至室温就转移到容量瓶中定容
③ 酸碱中和滴定时,盛装标准液的滴定管用蒸馏水洗净后,直接加入标准液
④ 酸碱中和滴定时,滴定前没有排除滴定管尖嘴处的气泡
⑤ 配制溶液时,转移前,容量瓶中含有少量蒸馏水
⑥ 配制溶液时,定容摇匀后,发现液面低于刻度线
⑦ 配制溶液时,定容时,俯视刻度线
A. ①②③④⑦ B. ①②④⑥⑦ C. ①②⑤⑦ D. ①②③④⑤⑦
【答案】A
【解析】依据配制一定物质的量浓度溶液的操作步骤判断;分析不当操作对溶质的物质的量和溶液的体积的影响,依据C=![]() 进行误差分析。
进行误差分析。
①洗涤量取浓H2SO4后的量筒,并将洗涤液转移到容量瓶中,导致量取的浓硫酸体积偏大,硫酸的物质的量偏大,溶液浓度偏高,故选①;
②未等稀释后的H2SO4溶液冷却至室温就转移到容量瓶中,冷却后,溶液体积偏小,溶液浓度偏高,故选②;
③当盛装酸标准液的滴定管未用标准液润洗,装入标准溶液后,残留的水稀释了酸溶液,在此浓度下与碱反应,就会多消耗酸的体积,但是,在计算碱的浓度时,待测碱浓度将偏高,故选③;
④酸式滴定管在滴定前有气泡,滴定后气泡消失,造成V(标准)偏大,根据c(待测)=![]() ,可知c(待测)偏大,故选④;
,可知c(待测)偏大,故选④;
⑤转移前,容量瓶中含有少量蒸馏水,对溶质的物质的量和溶液体积都不产生影响,溶液浓度不变,故不选⑤;
⑥定容摇匀后,发现液面低于标线,又用胶头滴管加蒸馏水至标线,导致溶液体积偏大,溶液浓度偏低,故不选⑥;
⑦定容时,俯视刻度线,导致溶液体积偏小,溶液浓度偏高,故选⑦;
综合以上分析,①②③④⑦偏高,
故答案为:A。


科目:高中化学 来源: 题型:
【题目】对于密闭容器中的反应2SO3(g)![]() O2(g)+2SO2(g),在一定条件下n(SO3)和n(O2)随时间变化的关系如图所示。下列叙述正确的是( )
O2(g)+2SO2(g),在一定条件下n(SO3)和n(O2)随时间变化的关系如图所示。下列叙述正确的是( )
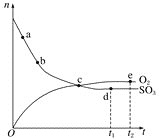
A. 点c处反应达到平衡B. 点b的正反应速率比点a的大
C. 点c的逆反应速率比点e的大D. 点d(t1时刻)和点e(t2时刻)处n(SO2)一样大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某稀硫酸和稀硝酸的混合溶液200mL,平均分成两等份。向其中一份中逐渐加入铜粉,最多能溶解19.2g (已知硝酸只被还原为NO气体)。向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如下图所示。下列分析或结果错误的是

A. OA段产生的是NO,AB段的反应为Fe+2Fe3+=3Fe2+,BC段产生氢气
B. 原混合酸中SO42-物质的量为0.6 mol
C. 第二份溶液中最终溶质为FeSO4
D. 取20mL原混合酸加水稀释至1L后溶液的c(H+)=0.2mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关化学反应的叙述正确的是( )
A.用酒精灯加热Fe(OH)3生成FeOB.实验室加热NH4Cl固体制取NH3
C.SO2和过量氨水反应生成(NH4)2SO3D.Na在空气中燃烧制取Na2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面关于硅及其化合物的叙述中,不正确的是 ( )
A.可用氢氟酸在玻璃上雕刻花纹
B.晶体硅可用作半导体材料
C.硅胶可用作食品干燥剂
D.硅元素化学性质不活泼,在自然界中可以游离态形式存在
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于单质铁的性质,下列说法中正确的是( )
A.铁与高温水蒸气反应生成Fe2O3B.铁与硫单质反应生成Fe2S3
C.生铁是一种铁-碳合金D.常温下,冷的浓硫酸与铁单质不反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是制取、洗涤并测量生成气体体积的装置示意图,利用上述装置进行下表所列实验,能达到试验目的是( )
物质实验 | a(液体) | b(固体) | c(液体) |
A | 稀盐酸 | 锌粒 | 浓H2SO4 |
B | 浓盐酸 | MnO2 | 浓H2SO4 |
C | 稀硫酸 | CaCO3 | 浓H2SO4 |
D | 浓氨水 | 生石灰 | 浓H2SO4 |

A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验操作、现象、目的及结论都正确的是
选项 | 实验 | 现象结论 |
A | 向浓度均为 0.1 molL1 NaCl 和 Na2CrO4混合溶液中滴加0.1 molL1 AgNO3 溶液,先生成白色的AgCl沉淀 | 能证明Ksp(AgCl)< Ksp(Ag2CrO4) |
B | 向植物油和矿物油中分别加入烧碱溶液,加热,冷却后观察是否分层 | 不能区别植物油和矿物油 |
C | 其他条件相同,一只试管中加入5mL 0.2mol/LH2C2O4 (aq)和2.5L 0.1mol/L KMnO4(aq);另一支试管中加入7.5ml 0.2moI/L H2C2O4 (aq)和 2.5mL 0.2mol/L KMnO4(aq) 和5mlH2O | 可验证相同条件下浓度对化学反应速率的影响 |
D | 常温下,用pH计测定0.1moI/L NaA溶液的pH小于0.1moI/L Na2CO3溶液的pH | 能证明酸性:HA>H2CO3 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某充电宝锂离子电池的总反应为:xLi + Li1-xMn2O4![]() LiMn2O4,某手机镍氢电池总反应为:NiOOH + MH
LiMn2O4,某手机镍氢电池总反应为:NiOOH + MH![]() M+ Ni(OH)2(M为储氢金属或合金),有关上述两种电池的说法不正确的是:
M+ Ni(OH)2(M为储氢金属或合金),有关上述两种电池的说法不正确的是:
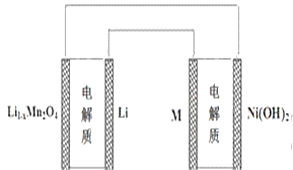
A. 锂离子电池放电时Li+向正极迁移
B. 镍氢电池放电时,正极电极反应式:NiOOH+H2O +e-==Ni(OH)2+OH-
C. 上图表示用锂离子电池给镍氢电池充电
D. 锂离子电池充电时,阴极的电极反应式: LiMn2O4—xe-== Li1-xMn2O4+ xLi+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com