
| A. | 在无色溶液中:NH4+、Fe2+、SO42-、CO32- | |
| B. | 在含有大量Ba2+ 的溶液中:NH4+、Na+、Cl-、CO32- | |
| C. | 在强碱性溶液中:Na+、Cl-、K+、SO42- | |
| D. | 在强酸性溶液中:K+、Fe2+、Cl-、HCO3- |
科目:高中化学 来源: 题型:多选题
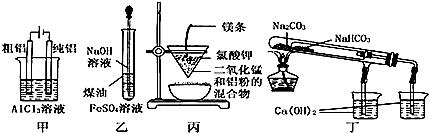
| A. | 用甲图装置电解精炼铝 | |
| B. | 用乙图装置制备 Fe(OH)2 | |
| C. | 用丙图装置可制得金属锰 | |
| D. | 用丁图装置验证 NaHCO3 和 Na2CO3的热稳定性 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
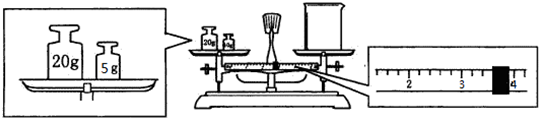
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 过程①的提纯是物理过程,过程②通过氧化还原反应可产生2种单质 | |
| B. | 在过程③中将MgCl2•6H2O灼烧即可制得无水MgCl2 | |
| C. | 在过程④、⑥反应中每氧化0.2 mol Br-需消耗0.1mol Cl2 | |
| D. | 除去粗盐中的SO42-、Ca2+、Mg2+、Fe3+等杂质,加入的药品顺序为:Na2CO3溶液→NaOH溶液→BaCl2溶液→过滤后加盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 纯净物②③⑥ | B. | 混合物①③④ | C. | 电解质②⑥ | D. | 非电解质④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
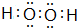 该物质能使酸性KMnO4溶液褪色,在这个反应中体现了该物质的还原性(填“氧化性”或“还原性”)
该物质能使酸性KMnO4溶液褪色,在这个反应中体现了该物质的还原性(填“氧化性”或“还原性”)查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| t/min | X/mol | Y/mol | Z/mol |
| 0 | 1.00 | 1.00 | 0.00 |
| 1 | 0.90 | 0.80 | 0.20 |
| 3 | 0.75 | 0.50 | 0.50 |
| 5 | 0.65 | 0.30 | 0.70 |
| 9 | 0.55 | 0.10 | 0.90 |
| 10 | 0.55 | 0.10 | 0.90 |
| 14 | 0.55 | 0.10 | 0.90 |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com