
| A. | 盐酸与Fe(OH)3反应:Fe(OH)3+3H+═Fe3++3H2O | |
| B. | 稀硫酸与铁粉反应:2Fe+6H+═2Fe3++3H2↑ | |
| C. | 氢氧化钡溶液与稀硫酸反应:Ba2++SO42-═BaSO4↓ | |
| D. | 碳酸钙与盐酸反应:CO32-+2H+═H2O+CO2↑ |
分析 A.二者反应生成氯化铁和水;
B.不符合反应客观事实;
C.漏掉氢离子与氢氧根离子的反应;
D.碳酸钙为沉淀,应保留化学式.
解答 解:A.盐酸与Fe(OH)3反应,离子方程式:Fe(OH)3+3H+═Fe3++3H2O,故A正确;
B.稀硫酸与铁粉反应,离子方程式:Fe+2H+═Fe2++H2↑,故B错误;
C.氢氧化钡溶液与稀硫酸反应,离子方程式:2OH-+2H++Ba2++SO42-═BaSO4↓+2H2O,故C错误;
D.碳酸钙与盐酸反应,离子方程式:CaCO3+2H+═H2O+CO2↑+Ca2+,故D错误;
故选:A.
点评 本题考查了离子方程式的书写方法和正误判断,明确物质的性质及发生反应是解题关键,注意离子反应遵循客观事实、遵循原子个数、电荷数守恒规律,注意化学式的拆分,题目难度不大.


科目:高中化学 来源: 题型:解答题
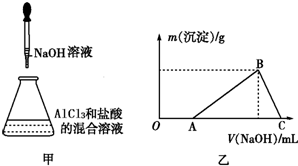 某同学称取一定质量的AlCl3固体配成溶液,在该溶液中加入一定量的稀盐酸,然后向此混合溶液中逐滴加入NaOH溶液如图甲所示.滴加过程中产生沉淀的质量与加入NaOH溶液的体积的关系如图乙所示.
某同学称取一定质量的AlCl3固体配成溶液,在该溶液中加入一定量的稀盐酸,然后向此混合溶液中逐滴加入NaOH溶液如图甲所示.滴加过程中产生沉淀的质量与加入NaOH溶液的体积的关系如图乙所示.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 温度/℃ | 0 | 20 | 40 | 60 | 80 | 100 |
| 溶解度/g | 122 | 216 | 311 | 440 | 585 | 733 |
| 温度/℃ | 0 | 20 | 40 | 60 | 80 | 100 |
| 溶解度/g | 122 | 216 | 311 | 440 | 585 | 733 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| R | ||
| X | T | Z |
| Q |
| A. | X的最高价氧化物能溶于强碱 | B. | 非金属性:T>R | ||
| C. | 单质导电性:Z>T>X | D. | R与Q的原子核外电子数相差16 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 生成氯气的相对分子质量为71 | B. | 生成1 mol氯化钾转移5 NA个电子 | ||
| C. | 生成氯化钾的摩尔质量为76 g/mol | D. | 1molH37Cl参加反应转移NA个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
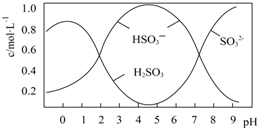 葡萄酒常用Na2S2O5做抗氧化剂.
葡萄酒常用Na2S2O5做抗氧化剂.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
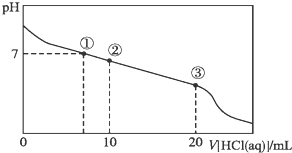
| A. | 点①所示溶液中,溶质为未反应完的CH3COONa、生成的CH3COOH和NaCl,微粒之间的关系为:c(CH3COOH)>c(Cl-)>c(OH-)=c(H+) | |
| B. | 点②所示溶液中,醋酸钠有一半与盐酸反应,微粒之间的关系为:c(Na+)>c(Cl-)>c(CH3COO-)>c(CH3COOH) | |
| C. | 点③所示溶液中,醋酸钠与盐酸恰好完全反应,微粒之间的关系为:c(Na+)>c(CH3COOH)>c(H+)>c(CH3COO-) | |
| D. | 整个过程中有可能出现:c(H+)+c(Na+)=c(CH3COOH)+c(CH3COO-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
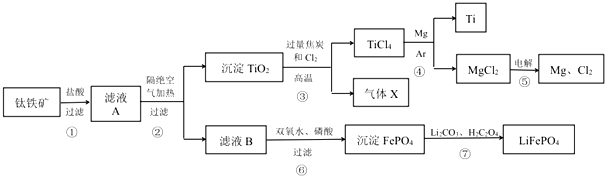
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶剂质量不变 | B. | 溶质质量变大 | C. | 溶液的浓度不变 | D. | 溶解度增大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com