
【题目】甲醇是重要的工业原料.煤化工可以利用煤炭制取水煤气从而合成甲醇:CO(g)+2H2(g)CH3OH(g).已知常温常压下反应的能量变化如图1所示: 
②
化学键 | H﹣H | H﹣O | O=O |
键能kj/mol | 436 | x | 496 |
③CO(g)+ ![]() O2(g)=CO2(g)△H=﹣280kJ/mol
O2(g)=CO2(g)△H=﹣280kJ/mol
H2(g)+ ![]() O2(g)=H2O(I)△H=﹣284kJ/mol
O2(g)=H2O(I)△H=﹣284kJ/mol
H2O(I)=H2O(g)△H=+44kJ/mol
请回答下列问题:
(1)甲醇气体分解为CO和H2两种气体这一反应的活化能为kj/mol;
(2)请写出表示气态甲醇燃烧热的热化学方程式;
(3)H﹣O的键能x值为;
(4)如图2:在一容积可变的密闭容器中充入10molCO气体和30molH2气体,当达到平衡状态A时,容器的体积为20L.如反应开始时仍充入10molCO和30molH2 , 则在平衡状态B时容器的体积V(B)=L;
(5)在甲、乙、丙三个不同密闭容器中按不同方式投料,一定条件下发生该反应(起始温度和起始体积相同,反应物和生成物反应前后均为气态).相关数据如表所示:
容器 | 甲 | 乙 | 丙 |
相关条件 | 恒温恒容 | 绝热恒容 | 恒温恒压 |
反应物投料 | 1molCO、2molH2 | 1molCH3OH | 1molCH3OH |
平衡时容器体积 | V(甲) | V(乙) | V(丙) |
反应的平衡常数K | K(甲) | K(乙) | K(丙) |
平衡时CH3OH的浓度/molL﹣1 | C(甲) | C(乙) | C(丙) |
平衡时CH3OH的反应速率/molL﹣1min﹣1 | v(甲) | v(乙) | v(丙) |
则下列说法正确的是 .
A.V(甲)>V(丙)
B.K(乙)>K(丙)
C.c(乙)>c(甲)
D.v(甲)=v(丙)
【答案】
(1)510
(2)CH3OH(g)+ ![]() O2(g)=CO2(g)+2H2O(l)△H=﹣757kJ?mol﹣1
O2(g)=CO2(g)+2H2O(l)△H=﹣757kJ?mol﹣1
(3)462
(4)7
(5)B,C
【解析】解:(1)由图形可知甲醇的活化能为(419+91)kJ/mol=510kJ/mol,
故答案为:510;
(2)燃烧热的热化学方程式中,可燃物为1mol,反应生成稳定的氧化物.
由图1可得热化学方程式:①CO(g)+2H2(l)=CH3OH(g)△H=﹣91kJ/mol,
又已知:②CO(g)+ ![]() O2(g)═CO2(g)△H=﹣280kJ/mol
O2(g)═CO2(g)△H=﹣280kJ/mol
③H2(g)+ ![]() O2(g)═H2O(l)△H=﹣284 kJ/mol
O2(g)═H2O(l)△H=﹣284 kJ/mol
根据盖斯定律,③×2+②﹣①可得:CH3OH(g)+ ![]() O2(g)=CO2(g)+2H2O(l)△H=﹣757kJmol﹣1,
O2(g)=CO2(g)+2H2O(l)△H=﹣757kJmol﹣1,
故答案为:CH3OH(g)+ ![]() O2(g)=CO2(g)+2H2O(l)△H=﹣757kJmol﹣1;
O2(g)=CO2(g)+2H2O(l)△H=﹣757kJmol﹣1;
(3)已知:H2(g)+ ![]() O2(g)═H2O(l)△H=﹣284 kJ/mol,
O2(g)═H2O(l)△H=﹣284 kJ/mol,
H2O(l)═H2O(g)△H=+44kJ/mol
二者相加可得:H2(g)+ ![]() O2(g)═H2O(g)△H=﹣240 kJ/mol,
O2(g)═H2O(g)△H=﹣240 kJ/mol,
反应热=反应物总键能﹣生成物总键能,则436kJ/mol+ ![]() ×496kJ/mol﹣2×x kJ/mol=﹣240kJ/mol,解得x=462,
×496kJ/mol﹣2×x kJ/mol=﹣240kJ/mol,解得x=462,
故答案为:462;
(4)A、B两容器温度相同,即化学平衡常数相等,A点时转化率为50%,则K= ![]() =1,且B点时CO的转化率为0.8,则
=1,且B点时CO的转化率为0.8,则
CO(g)+ | 2H2(g) | CH3OH(g) | |
起始(mol) | 10 | 30 | 0 |
转化(mol) | 8 | 16 | 8 |
平衡(mol) | 2 | 14 | 8 |
设体积为VL,则有K=  =1,V=7L,
=1,V=7L,
故答案为:7;
(5)A.丙为甲醇的分解是气体体积增大的反应,所以丙恒温恒压,体积变大,甲恒温恒容,体积不变,所以,V甲<V丙,A不符合题意;
B.合成甲醇是放热反应,其逆反应甲醇分解就是吸热的,乙绝热容器,丙恒温,所以乙反应后比丙温度低,向吸热方向进行的程度小,平衡时乙中甲醇浓度比丙高,CO和氢气浓度比丙低,K乙>K丙,B符合题意;
C.条件相同时,甲与乙是等效平衡.甲与乙容器体积相同,乙分解甲醇吸热导致乙比甲温度低,平衡向合成甲醇方向移动,平衡时甲醇浓度乙大于甲,即c乙>c甲,C符合题意;
D.甲与丙起始温度和起始体积相同,恒温条件下反应,丙在恒压条件下分解甲醇生成氢气和CO,平衡时体积比反应前大,即平衡时丙体积大于甲,则压强甲大于丙,所以υ甲>υ丙,D不符合题意.
故答案为:BC.
(1)掌握研究化学反应原理的简化的理论模型;(2)燃烧热与盖斯定律的综合应用;(3)利用键能求焓变;(4)三行式的应用;(5)注意不同容器及不同方式投料对可逆反应的影响,但化学平衡常数只受温度的影响。


 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案科目:高中化学 来源: 题型:
【题目】下列反应中符合H+ + OH-=H2O离子反应的是( )
A.稀硫酸与稀氨水B.稀硫酸与氢氧化钡溶液
C.稀硝酸与氢氧化钡溶液D.盐酸与氢氧化铁反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼化钒(VB2)—空气电池是目前储电能力最高的电池,电池示意图如右图,该电池工作时反应为4VB2+ 11O2=4B2O3+2V2O5。下列说法正确的是
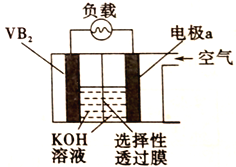
A. VB2极为负极,发生还原反应 B. 图中选择性透过膜只能让阳离子选择性透过
C. 电子由VB2极经导线、负载流向电极a D. 电极a上发生反应为O2+2H2O-4e-=4OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面是某工厂利用电镀污泥(主要含有Fe2O3、CuO、Cr2O3及部分难溶杂质)回收铜和铬的流程:

请回答下列问题:
已知部分物质沉淀的pH及CaSO4的溶解度曲线如下:
(1)在浸出过程中除生成Cr2(SO4)3外,主要还生成__________________。
(2)流程中“第一次调节“pH”是为了除去Fe3+,所加试剂X可以是_______(任写一种)。当离子浓度小于或等于1×10-5时可认为沉淀完全,若要使Fe3+完全沉淀,则应调节溶液pH≥__________已知(Ksp[Fe(OH)3]=8×10-38,1g2=0.3)
(3)写出还原步骤中生成Cu2O沉淀反应的离子方程式______________________________。此步骤中若NaHSO3过量。除了浪费试剂外,还可能出现的问题是________________________。
(4)流程中“第二次调节pH”应小于9,因为Cr(OH)3是两性氢氧化物,试写出Cr(OH)3与NaOH溶液反应的离子方程式___________________________。
(5)Cr(OH)3受热分解为Cr2O3,再用铝热法可以得到金属Cr。写出其中用铝热法冶炼得到金属Cr的化学方程式________________________________。
(6)化学需氧量(COD)可量度水体受有机物污染的程度,以K2Cr2O7作强氧化剂处理水样时所消耗的K2Cr2O7的量换算成相当于O2的含量(以mg·L-1计)来计量。
①处理时,水样应先酸化,最好选用__________(选填“稀硝酸”、“稀硫酸”或“稀盐酸”)酸化。
②在该条件下,Cr2O72-最终转化为Cr3+、取水样100mL,处理该水样时消耗了10mL0.025 mol·L-1 K2Cr2O7溶液。则该水样的COD为__________ mg·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高温下,某反应达平衡,化学平衡常数表达式为: ![]() ,恒容时,温度升高H2浓度减小.下列说法正确的是( )
,恒容时,温度升高H2浓度减小.下列说法正确的是( )
A.该反应化学方程式为:CO(g)+H2O(g)CO2(g)+H2(g)
B.恒温恒容下,反应达平衡时,再通入一定量的CO2气体,CO的体积分数一定增大
C.升高温度,正反应速率增大,逆反应速率减小
D.该反应的焓变为正值
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数,下列叙述中正确的是( )
A. 已知N2(g)+3H2(g)![]() 2NH3(g) △H=-92.4 kJ·mol-1,当在一定温度压强下向一密闭容器中充入0.5molN2、1.5molH2使其充分反应,其反应放出的热量为46.2 kJ
2NH3(g) △H=-92.4 kJ·mol-1,当在一定温度压强下向一密闭容器中充入0.5molN2、1.5molH2使其充分反应,其反应放出的热量为46.2 kJ
B. 常温常压下,7.1gCl2与足量铁充分反应,转移的电子数为0.2NA
C. 室温下,1LpH=13的NaOH溶液中,由水电离的OH-数目为0.1NA
D. 12g金刚石晶体中含有的碳碳键数目为4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】雷雨天闪电时空气中的臭氧(O3)生成,下列说法正确的是( )
A.O2和O3互为同位素
B.O2和O3的相互转化是物理变化
C.在相同的温度与压强下,等体积的O2和O3含有相同的分子数
D.等物质的量的O2和O3具有相同的质子数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应2SO2(g)+O2(g) ![]() 2SO3(g) △H<0一定条件下在某密闭容器中达到平衡。t1时改变某一条件,反应速率与时间关系如下图。下列说法中正确的是( )
2SO3(g) △H<0一定条件下在某密闭容器中达到平衡。t1时改变某一条件,反应速率与时间关系如下图。下列说法中正确的是( )
A.维持温度、反应体系体积不变,t1时充入SO3(g)
B.维持压强不变,t1时升高反应体系温度
C.维持温度不变,t1时扩大反应体系体积
D.维持温度、容器体积不变,t1时充入SO3(g),同时减少SO2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com