
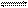 2NH3��
2NH3�� L��
L�� l��NH3 _______mol��
l��NH3 _______mol��
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 2NO(g) ��H > 0��֪�÷�Ӧ��2404��ʱ��ƽ�ⳣ��K=64��10-4����ش�
2NO(g) ��H > 0��֪�÷�Ӧ��2404��ʱ��ƽ�ⳣ��K=64��10-4����ش�| A������1molN2ͬʱ����1molO2 | B����������ܶȲ��� |
| C���������ƽ����Է����������� | D��2V(N2)��=V(NO)�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 ӦCO(g)��2H2(g)?CH3OH(g)�ﵽ��ѧƽ��״̬��
ӦCO(g)��2H2(g)?CH3OH(g)�ﵽ��ѧƽ��״̬��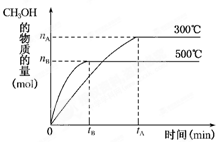
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
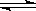 qZ(g)����H��0��m��n��q���ں����ܱ������з�Ӧ�ﵽƽ��ʱ�������й�˵����ȷ����
qZ(g)����H��0��m��n��q���ں����ܱ������з�Ӧ�ﵽƽ��ʱ�������й�˵����ȷ����| A���������ͨ��һ����ij����ʹ��ϵѹǿ����ƽ�⽫�����ƶ� |
| B����ʱ��X������Ӧ������Y���淴Ӧ���ʵ�m/n�� |
| C����������¶ȣ��ұ�������״̬�������ı䣬��������ƽ����Է���������С |
| D���������X�����ʵ�����ƽ�������ƶ���X��ת�������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
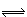 N2O4������ӦΪ���ȷ�Ӧ����������ƿ������ˮ�У��������������ȷ����
N2O4������ӦΪ���ȷ�Ӧ����������ƿ������ˮ�У��������������ȷ���� | A����ɫ���� | B����ɫ��dz | C����ɫ���� | D�����ж� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
A����ˮ��������ƽ��Br2+H2O HBr + HBrO,������AgNO3��Һ����Һ��ɫ��dz HBr + HBrO,������AgNO3��Һ����Һ��ɫ��dz |
| B���ϳɰ���ҵ��ʹ������ý������ |
| C���ϳ�NH3��Ӧ��Ϊ���NH3�IJ��ʣ�������Ӧ��ȡ���¶ȵĴ�ʩ |
D����2HI��g�� H2(g)+I2(g)����������������䣬ͨ��������ʹƽ����ϵ��ɫ��dz H2(g)+I2(g)����������������䣬ͨ��������ʹƽ����ϵ��ɫ��dz |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
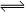 CO(g)+H2(g)��ƽ�ⳣ��(K)��д��ʽ����ȷ���ǣ� ��
CO(g)+H2(g)��ƽ�ⳣ��(K)��д��ʽ����ȷ���ǣ� ��
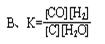
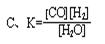
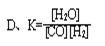
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
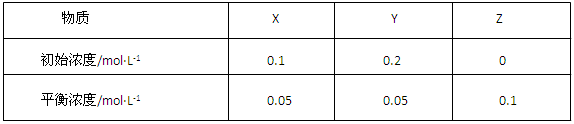
| A����Ӧ�ﵽƽ��ʱ��X��ת����Ϊ50�� |
B����Ӧ�ɱ�ʾΪX+3Y 2Z����ƽ�ⳣ��Ϊ1600 2Z����ƽ�ⳣ��Ϊ1600 |
| C������ѹǿʹƽ��������Z�ķ����ƶ���ƽ�ⳣ������ |
D���ı��¶ȿ��Ըı�� ��Ӧ��ƽ�ⳣ�� ��Ӧ��ƽ�ⳣ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 B��D ��B��D��ʼŨ��Ϊ0�������ֲ�ͬ�����½��С���Ӧ��A��Ũ�ȣ�mol/L���淴Ӧʱ�䣨min���ı仯������±��������������ݣ������գ�
B��D ��B��D��ʼŨ��Ϊ0�������ֲ�ͬ�����½��С���Ӧ��A��Ũ�ȣ�mol/L���淴Ӧʱ�䣨min���ı仯������±��������������ݣ������գ�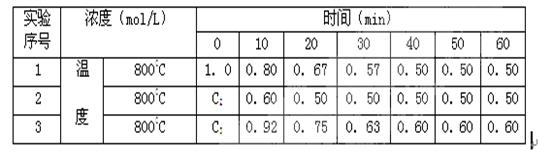
 2A��������������, B��D����ʼŨ��Ϊ0.50 mol/L , A����ʼŨ��Ϊ0, �ﵽƽ��ʱA��Ũ��Ϊ mol/L, B��ת���ʣ� ��
2A��������������, B��D����ʼŨ��Ϊ0.50 mol/L , A����ʼŨ��Ϊ0, �ﵽƽ��ʱA��Ũ��Ϊ mol/L, B��ת���ʣ� ���鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com