
| 容器 | 甲 | 乙 |
| 反应物投入量 | 1mol CO2(g)和3mol H2(g) | 1mol CH3OH(g)和1mol H2O(g) |
| 平衡时c(CH3OH) | c1 | c2 |
| 平衡时能量变化 | 放出29.4kJ | 吸收a kJ |
| 29.4kJ |
| 49.0kJ |
| ||
| 10s |
| c(CH3OH) |
| c(CO)c2(H2) |
| 0.5b |
| 0.5b×b2 |
| 1 |
| b2 |
| 1 |
| b2 |


科目:高中化学 来源: 题型:
| A、NH4+、NO3-、SiO32-、Na+ |
| B、Na+、Ba2+、HCO3-、AlO2- |
| C、NO3-、Mg2+、K+、Cl- |
| D、NO3-、K+、AlO2-、OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将氯气通入澄清石灰水,获得漂白粉 |
| B、将煤进行干馏,获得焦炭、煤焦油等化工原料 |
| C、将石油分馏,获得乙烯、丙烯及1,3-丁二烯 |
| D、将浓盐酸和二氧化锰加热反应制备氯气 |
查看答案和解析>>
科目:高中化学 来源: 题型:
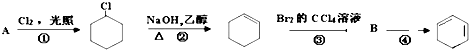
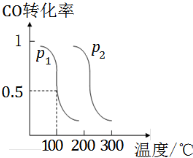
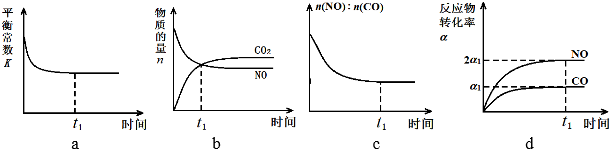
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、若所得溶液呈中性,则生成的盐可能为强酸强碱盐 |
| B、若所得溶液呈碱性,则可能是强碱与弱酸溶液反应 |
| C、若所得溶液呈酸性,则可能是弱酸与强碱溶液反应 |
| D、若所得溶液的pH=5.则可能是强碱与弱酸溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、从合成塔出来的气体,其中氨气一般占15%,所以生产氨的工业的效率都很低 |
| B、由于NH3易液化,N2、H2可循环使用,则总的说来氨的产率很高 |
| C、合成氨工业的反应温度控制在400~500℃左右,是因为该条件下氨的产率最高 |
| D、合成氨工业采用10 MPa~30MPa,是因该条件下催化剂的活性最好 |
查看答案和解析>>
科目:高中化学 来源: 题型:
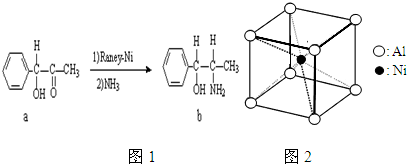
查看答案和解析>>
科目:高中化学 来源: 题型:
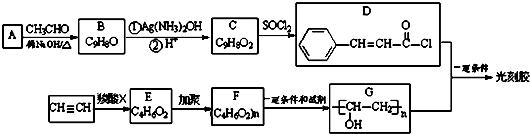
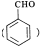
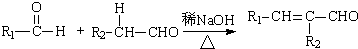 (R,R′为烃基或氢)
(R,R′为烃基或氢)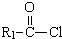 +R2OH
+R2OH| 一定条件 |
 +HCl(R,R′为烃基)
+HCl(R,R′为烃基)| NaOH溶液 |
| △ |
| CH3COOH |
| 浓硫酸.△ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com