
����Ŀ��̫���ܵ�ذ���ϳ��������⣬����ͭ�������ء����Ȼ�ѧ���ʡ�
��1����̬��ԭ�ӵĵ����Ų�ʽ��_______________��
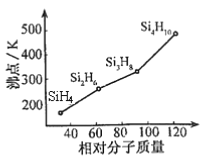
��2����һ���������л��軯����й��顣�������ɡ��ṹ����Ӧ���������ơ������й��ȡ____�ӻ���ʽ������ķе�����Է��������Ĺ�ϵ��ͼ��ʾ���������ֱ仯��ԭ����_______________��
��3��������ͬΪVIA��Ԫ�أ��������ڵ�Ԫ��������壬������Ԫ�صĵ縺����С�����˳��Ϊ_______�� (��Ԫ�ط��ű�ʾ)
��4����̬SeO3���ӵ����幹��Ϊ_________����SeO3��Ϊ�ȵ������һ������Ϊ____________(�ѧʽ)��
��5��һ��ͭ��Ͻ�����������������ܶѻ��ṹ���ھ����н�ԭ��λ�ڶ��㣬ͭԭ��λ�����ģ���úϽ��н�ԭ��(Au)��ͭԭ��(Cu)������Ϊ_________�����þ���ľ����ⳤΪa pm����úϽ��ܶ�Ϊ______g/cm 3��(�г�����ʽ����Ҫ�������������٤��������ֵΪNA)
���𰸡�
��1�� 1s2 2s22p63s23p2
��2�� sp3(1 ��) �������Է�������Խ���Ӽ䷶�»���Խǿ
��3�� As��Se��Br
��4�� ƽ��������(1 ��) CO32�� �� NO3��
��5�� 1��3 ��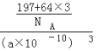
��������
�����������1������14��Ԫ�أ�����ԭ�Ӻ�������Ų����ɿ���д�������Ų�ʽΪ��1s22s22p63s23p2��
��2�����ݹ���ķ���ʽ�ó��������ͨʽΪ��SinH2n+2���ֹ������ɡ��ṹ����Ӧ���������ƣ����Թ����й��ȡsp3�ӻ���ʽ������(SinH2n+2)���Ƿ��Ӿ��壬���Ӿ���ķе�ߵ�ȡ���ڷ��Ӽ��������������Ӽ�����������Է��������Ĵ�С�йأ��������Է�������Խ���Ӽ䷶�»���Խǿ
��3���顢����������Ԫ�ض��ǵ�4���ڷǽ���Ԫ�أ�ͬһ����Ԫ��������ҵ縺�Գ��������ƣ��ʵ縺��As��Se��Br
��4����̬SeO3����������ԭ�ӵļ۲���Ӷ���Ϊ![]() =3���µ��Ӷԣ����Է��ӹ���Ϊƽ�������Σ��ֵȵ�����Ҫ��ԭ��������ͬ���۵�������ͬ��������SeO3��Ϊ�ȵ������һ������ΪCO32-��NO3-
=3���µ��Ӷԣ����Է��ӹ���Ϊƽ�������Σ��ֵȵ�����Ҫ��ԭ��������ͬ���۵�������ͬ��������SeO3��Ϊ�ȵ������һ������ΪCO32-��NO3-
��5���ھ����У�Auԭ��λ�ڶ��㣬Cuԭ��λ�����ģ��þ�����Auԭ�Ӹ���=8��![]() =1��Cuԭ�Ӹ���=6��
=1��Cuԭ�Ӹ���=6��![]() =3�����ԸúϽ���Auԭ����Cuԭ�Ӹ���֮��=1��3���������V=(a��10-10cm)3��ÿ��������ͭԭ�Ӹ�����3��Auԭ�Ӹ�����1�����=
=3�����ԸúϽ���Auԭ����Cuԭ�Ӹ���֮��=1��3���������V=(a��10-10cm)3��ÿ��������ͭԭ�Ӹ�����3��Auԭ�Ӹ�����1�����=![]() gcm-3��
gcm-3��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ʳ��ά����ͻ���ı������ܣ��������������Ӫ��������ľ������һ�ַ�������ʳ��ά���䵥��֮һ---���Ӵ��ṹ��ʽ����ͼ��ʾ�������йؽ��Ӵ���˵����ȷ����( )
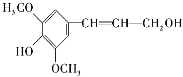
A�����Ӵ������������ֹ�����
B�����Ӵ�����������̼ԭ�Ӳ�������ͬһƽ����
C��1mol���Ӵ�������Ũ��ˮ��Ӧ���������3molBr2
D�����Ӵ��ܷ����ķ�Ӧ������������ȡ�����ӳ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����绷�����˽���ȫ���ֹʹ��������������ˮ����������������ø�Ч����ɫ���������������ȡ�����������һ�ּ��ױ�ը��ǿ���������壬������ˮ�����ȶ����ʻ���ɫ����������ʹ��ʱ���뾡����ϡ���������ϡ�ͣ�ͬʱ��Ҫ������ա�����ȡ�ʵ�����Ե�ⷨ�Ʊ�ClO2���������£�
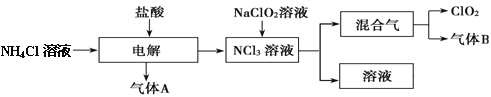
��1��ClO2������ԭ�� ����ǡ����ǡ���������8���ӽṹ����ͼ��ʾ��ⷨ�ƵõIJ�������������B��ʹʯ����Һ����ɫ����ȥ���������ѡ�� ��
A������ʳ��ˮ B����ʯ�� C��Ũ���� D�����Ȼ�̼
��2���ȶ��Զ���������Ϊ�ƹ�������ȶ����������Ͳ�Ʒ������˵����ȷ���� ��
A���������ȿɹ㷺���ڹ�ҵ������ˮ����
B��Ӧ����ʳƷ��ҵ������Ч���ӳ�ʳƷ������
C���ȶ��Զ������ȵij��ִ�������˶������ȵ�ʹ�÷�Χ
D���ڹ������ͳ�Ʒ�������ڣ�Ҫ��ͨ��װ�úͼ�⼰����װ��
��3��ŷ������Ҫ��������������Ũ�����Ʊ�����ѧ��Ӧ����ʽΪ ��
ȱ����Ҫ�Dz��ʵ͡���Ʒ���Է��룬��������Ⱦ������
��4���ҹ��㷺���þ��������ϡ�͵�����������������ƣ�NaClO2����Ӧ�Ʊ�����ѧ����ʽ�� ���˷����ŷ�������ŵ��� ��
��5����ѧ�����о�����һ���µ��Ʊ����������������ữ�IJ��ᣨH2C2O4����Һ��ԭ�����ƣ���ѧ��Ӧ����ʽΪ ���˷���������������桢����İ�ȫ�ԣ�ԭ���� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ȼ�ϵ�ص�ⱥ��ʳ��ˮ��װ����ͼ��ʾ��a��bΪʯī�缫��������U�ι���������ܽ���a�ϲ���������ȫ������С�Թ��У���
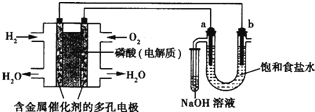
��1��д��ͨ��H2��һ���ĵ缫��Ӧ_________��ͨ��O2��һ���ĵ缫��ӦΪ_________��
��2��aΪ_________�����缫��ӦΪ_________ ��
��3��bΪ_________�����缫��ӦΪ_________��
��4����25������ȼ�ϵ�������� 0.02g H2ʱ��U�ι���Һ������Ϊ200mL������ʵ�����������ı仯���� ���ʱU�ι�����Һ��pH��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ý�屨����������ȼ�ϵ��Ϊ�����Ĺ����������ڱ��������С����ӽ���Ĥȼ�ϵ��(PEMFC) ����Ϊ�綯�����Ķ���Դ����ȼ�ϵ��������Ϊȼ�ϣ�����Ϊ����������������������������H+�����жԸ�ȼ�ϵ�ص���������ȷ����
��������ӦΪ��O2+4H++4e- �T2H2O
��������ӦΪ��2H2-4e- �T4H+
���ܵĻ�ѧ��ӦΪ��2H2+O2![]() 2H2O
2H2O
��H+ͨ��������������ƶ�
A���٢ڢۢ� B���ڢۢ� C���٢ڢ� D���٢ڢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ԫ�����ڱ���ѧϰ���ʼܹ������ʵ���Ҫ���ߡ������Ԫ���١��������ڱ��е�λ�ã��ش��������⣺

��1��Ԫ������Ԫ�����ڱ���λ��Ϊ____________��
��2����ԭ�Ӹ�����Ϊ1��1��1������������ ����Ԫ����ɹ��ۻ�����X�����γ�4�Թ��õ��Ӷԣ�X�ĽṹʽΪ ��
��3�������������������������������Ӧ��ˮ��������Һ�н��еĵ����ӷ�Ӧ����ʽ ��
��4���ɱ�������Ԫ�ص�ԭ�Ӱ�1:1��ɵ����ӻ����ﳣ�������������û������еĻ�ѧ������Ϊ ��
��5��A��B��D��E������������Ԫ����ɵĻ��������֮���ת����ϵ��ͼ��ʾ�����ֲ�������ȥ����A��B��D����ɫ��Ӧ���ʻ�ɫ��ˮ��Һ��Ϊ���ԡ���ش�
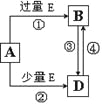
��E�ĵ���ʽΪ ��
����Ȼ���д���B��D��H2O��һ�������ᾧ���ɵĹ��塣ȡһ�����ù�������ˮ���100 mL��Һ�������Һ�н��������ӵ�Ũ��Ϊ0.5 mol/L����ȡ��ͬ�����Ĺ���������������ٷ����仯��ʣ����������Ϊ g��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1�����и������ӻ�Ϊͬλ�ص��� �����ţ���ͬ������Ϊͬ����������� ����Ϊͬ���칹����� ��Ϊͬϵ����� ��
��16O2��18O3
����������ͬ����������ͬ����������
��11H��D��T
��3015R��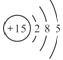 ������15�����ӣ�
������15�����ӣ�
�������Ǻ���
��
��CH3CH2CH2CH2CH2CH3����CH3��2CHCH��CH3��2
����CH3��2CHCH��CH3��2��C��CH3��4
��2�������е�һЩ���ⳣ�漰��ѧ֪ʶ������������ȷ���ǣ�����ţ� ��
�ٵ��ۡ������ʶ�����Ȼ�л��߷��ӻ�����
��ʳ��ֲ���͵���Ҫ�ɷ��Ǹ�������֬������������������Ӫ������
�۽�ֹʹ�ú�Ǧ������Ϊ��������͵�ȼ��Ч��
�ܸ���������һ�����õ�ɱ������Ҳ��������������ˮ
�����������������ļӿ죬�����С��װʳƷ�ѱ��㷺���ܣ�Ϊ�˷�ֹ�����±��ȸ�֬ʳƷ�������ʣ��ӳ�ʳƷ�ı����ڣ��ڰ�װ���г�������ʯ��
��������Һ�м�����NH4��2SO4Ũ��Һ�������ʻ���������ˮ�����ܽ�
��Ϊ��֤��øϴ�·۵�ϴ��Ч����Ӧ�÷�ˮ�ܽ�ϴ�·�
��3����ʵ�����������������Ŀ��淴Ӧ����Ӧ�ﲻ����ȫ����������Ӧһ��ʱ����ʹﵽ�˸÷�Ӧ���ȣ�Ҳ���ﵽ��ѧƽ��״̬������������˵���Ҵ��������������Ӧ�Ѵﵽ��ѧƽ��״̬���У�����ţ� ��
�ٵ�λʱ�������1mol����������ͬʱ����1molˮ
�ڵ�λʱ�������1mol����������ͬʱ����1mol����
�۵�λʱ�������1mol�Ҵ���ͬʱ����1mol����
������Ӧ���������淴Ӧ���������
�ݻ�����и����ʵ�Ũ�Ȳ��ٱ仯
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��2011��9��29���ҹ��ɹ�����ġ��칬һ�š�����������Ǹ�����һ�����ͽṹ�մɲ��ϣ�����Ҫ�ɷ��ǵ����裬���մɲ��Ͽ���ʯӢ�����뽹̿�����ڸ��µĵ�������ͨ�����·�Ӧ�Ƶã�SiO2��C��N2![]() Si3N4��CO���÷�Ӧ�仯�����е������仯��ͼ��ʾ���ش��������⡣
Si3N4��CO���÷�Ӧ�仯�����е������仯��ͼ��ʾ���ش��������⡣

(1)������Ӧ�еĻ�ԭ����__________���仹ԭ������________��
(2)�÷�Ӧ________(����ȡ����ȡ�)����Ӧ�Ȧ�H________0(�>������<������)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����п�����ᷴӦ��ʵ���У�ijͬѧ�õ��Ľ�����±���ʾ��
п������/g | п����״ | �¶�/�� | п��ȫ�ܽ��ʱ��/s | |
A | 2 | ��Ƭ | 5 | 400 |
B | 2 | ��Ƭ | 15 | 200 |
C | 2 | ��Ƭ | 25 | 100 |
D | 2 | ��Ƭ | 35 | t1 |
E | 2 | ���� | 15 | t2 |
F | 2 | ��ĩ | 15 | t3 |
G | 2 | ��Ƭ(����������Cu) | 35 | t4 |
��1����Ӧ�����ӷ���ʽ�� ���÷�ӦΪ ��Ӧ������ȡ������ȡ�����
��2��t1��________s, �������ʱ����¶ȵ�����ͼ(�����ʾʱ�䣬�����ʾ�¶�)��
��3����������������ͼ��������ݣ��ɵó��÷�Ӧ���¶�Ӱ�췴Ӧ���ʵĹ�����__________��
��4��t1______(���������)t4��ԭ����________________________________��
t2________t3(���������)��ԭ����_______________________________��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com