
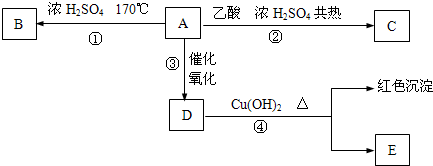
| 浓硫酸 |
| 170℃ |
| 浓硫酸 |
| 170℃ |
| 浓硫酸 |
| △ |
| 浓硫酸 |
| △ |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、钠熔成小球并在液面上游动 |
| B、有气体生成 |
| C、溶液底部有银白色固体生成 |
| D、溶液变浑浊 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
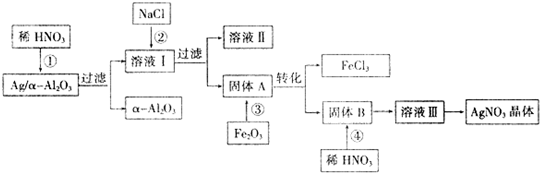
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、蒸馏操作时,冷凝水的方向应当由下往上 |
| B、分液操作时,首先要打开分液漏斗的上口活塞,或使活塞上的小孔与上口部的小孔对准,然后进行分液 |
| C、提取碘水中的碘单质时,应选择有机萃取剂,如酒精 |
| D、萃取分液后,要得到被萃取的物质,通常还要进行蒸馏 |
查看答案和解析>>
科目:高中化学 来源: 题型:
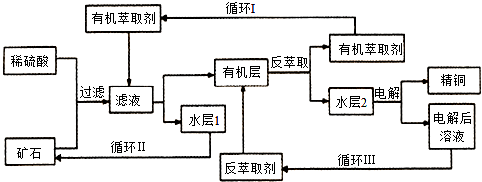
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com