
【题目】宋代著名法医学家宋慈的《洗冤集录》中有银针验毒的记载,“银针验毒”涉及的化学反应是:4Ag + 2H2S + O2 = 2X + 2H2O,下列说法不正确的是( )
A.X的化学式为Ag2S
B.还原性:H2S>H2O
C.每消耗11.2L O2,反应中转移电子的数目为2NA
D.根据价层电子对互斥理论,H2S的空间结构呈V型
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分。表中所列字母分别代表某一化学元素。

(1)下列 (填写编号)组元素的单质具有良好导电性。
①a、c、m ②b、g、k ③c、h、1 ④d、e、f
(2)电离能主要取决于原子核对核外电子的吸引力和形成稳定结构的倾向。下表是一些气态原子各级电离能的数据(kJ·mol-1):
锂 | X | Y | |
失去一个电子 | 519 | 502 | 580 |
失去二个电子 | 7296 | 4570 | 1820 |
失去三个电子 | 11799 | 6920 | 2750 |
失去四个电子 | 9550 | 11600 |
①为什么锂原子的第二电离能远远大于第一电离能 。
②用电子式表示X和j以原子个数1比1形成的一种化合物 。
③Y在周期表中是 族元素。
④e元素的电子排布式为
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生用化学知识解决生活中的问题,下列家庭小实验或说法不合理的是
A. 用米汤检验食盐中是否含碘酸钾(KIO3)
B. 用食醋除去暖水瓶中的薄层水垢
C. 医用酒精的浓度通常为75%,可用于杀菌消毒
D. 用灼烧并闻气味的方法区别纯棉织物和纯羊毛织物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应既属于氧化还原反应,又属于吸热反应的是( )。
A. 铝片与稀盐酸的反应
B. Ba(OH)2·8H2O和NH4Cl的反应
C. 灼热的炭与CO2的反应
D. 甲烷在氧气中的燃烧反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.一定温度下,在2 L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示:
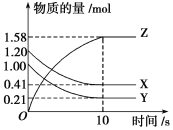
(1)从反应开始到10 s时,用Z表示的反应速率为_____________________________。
(2)该反应的化学方程式为__________________________________________________。
Ⅱ.在恒温恒容的密闭容器中,当下列物理量不再发生变化时:①混合气体的压强,②混合气体的密度,③混合气体的总物质的量,④混合气体的平均相对分子质量,⑤混合气体的颜色,⑥各反应物或生成物的反应速率之比等于化学计量数之比
(1)一定能证明2SO2(g)+O2(g)![]() 2SO3(g)达到平衡状态的是_______(填序号,下同)。
2SO3(g)达到平衡状态的是_______(填序号,下同)。
(2)一定能证明I2(g)+H2(g)![]() 2HI(g)达到平衡状态的是 ____________。
2HI(g)达到平衡状态的是 ____________。
(3)一定能证明A(s)+2B(g)![]() C(g)+D(g)达到平衡状态的是_________。
C(g)+D(g)达到平衡状态的是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(13分)乙酸正丁酯是一种水果香味的无色透明液体,常用于调制香料和药物。实验室用正丁醇和乙酸制备,反应原理如下:
CH3COOH+CH3CH2CH2CH2OH![]() CH3COOCH2CH2CH2CH3+H2O
CH3COOCH2CH2CH2CH3+H2O
某兴趣小组拟用如图装置制备少量乙酸正丁酯:

步骤1:加料。向干燥的100ml圆底烧瓶中加入37ml正丁醇、22ml冰醋酸及10滴浓硫酸(试剂加入顺序未确定),摇匀后,加入几粒沸石。然后安装分水器(先在分水器上端小心加水至分水器支管口处,然后再放出1~2ml的水)及回流冷凝管。
步骤2:加热回流。通过活塞控制分水器中水层液面的高度。反应完毕,停止加热。
步骤3:冷却(不可以拆卸回流冷凝管)。冷却至室温后,将烧瓶中的混合物与分水器中的酯层合并,转入分液漏斗中。
步骤4:依次用10ml水,10ml 10%碳酸钠溶液洗至中性(pH=7),再水洗一次,向洗涤后的有机相中加入适量的无水硫酸镁固体。放置一段时间后过滤、蒸馏、收集124~126℃馏分,得产品)
步骤5:用一干燥的小烧杯称产品,重量为29.0g。
相关物质的性质如下表:
物质名称 | 沸点/℃ | 熔点/℃ | 密度/g·cm-3 | 水中溶解度 |
正丁醇 | 117.3 | -89.5 | 0.80 | 7.1g/100g |
乙酸 | 118 | 16.6 | 1.0492 | 互溶 |
乙酸正丁酯 | 126.1 | -78 | 0.8826 | 1.4g/100g |
根据题意完成下列填空:
(1)加料时,三种试剂的加入顺序为 。
(2)该实验中,冷凝水从 (填“a”或“b”)口通入,使用分水器的目的是 。
(3)步骤2中判断反应结束的现象是 。
(4)步骤3中从分液漏斗中得到酯的操作 ,用10% Na2CO3溶液洗涤有机相,是为了除去有机相中的 (填结构简式)。
(5)步骤4中加入无水硫酸镁固体的作用是 。
(6)实验中正丁醇的转化率为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(12分)铈是一种重要的稀土金属元素,以下是其重要化合物Ce(OH)4的一种制备方法:
![]()
注:高铈是指溶液中Ce为+4价。
(1)高铈硫酸盐溶液可用于吸收硝酸工厂废气中的NO(如下图),则该反应过程中氧化产物为 。

(2)已知硫酸铈钠中各离子的物质的量之比为1:1:2,则硫酸铈钠的化学式为 。
(3)“还原”过程温度不能过高的原因是 。
(4)写出加入氨水时发生反应的离子方程式 。
(5)“氧化”过程若用NaClO代替O2,写出该反应的化学方程式 。
(6)为测定Ce(OH)4样品的纯度,现设计如下步骤:取上述样品2.68g用适量稀硫酸溶解后,加蒸馏水稀释至100ml。准确量取出20.00ml溶液于锥形瓶中,滴加2~3滴邻菲罗啉(指示剂),用0.1000mol·L-1 FeSO4标准溶液滴定至终点,并记录消耗FeSO4标准溶液的体积。将上述步骤重复2~3次,记录消耗标准溶液的平均体积为25.00ml,则产品的纯度为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学设计实验以探究元素性质的递变规律,实验装置如下图所示:

实验Ⅰ:根据元素最高价含氧酸的酸性强弱探究元素非金属性递变规律。
已知A装置的烧瓶里有大理石,分液漏斗里装有稀HNO3,B装置中装有饱和碳酸氢钠溶液,装置C中装有Na2SiO3溶液,试回答:
(1)A中反应的离子方程式为__________________________________。
(2)B装置的作用是____________,C中可观察到的现象是__________________________。
(3)根据实验现象推知,碳酸、硝酸、硅酸的酸性强弱顺序是________________,由此得出碳、硅、氮三种元素非金属性的强弱顺序是________。
实验Ⅱ:已知常温下高锰酸钾与浓盐酸混合可产生氯气,利用该装置探究氯和溴元素的非金属性强弱。(B装置中装有NaBr溶液,C装置中装有NaOH溶液)
(4)写出B装置中发生反应的离子方程式:___________________________________。
(5)C装置的作用是 。
(6)实验结论:非金属性:Cl______Br(填“>”或“<”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com