
某校化学兴趣小组探究SO2与FeCl3溶液的反应,所用装置如图所示。
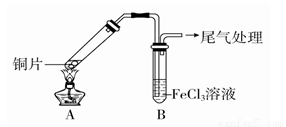
(1)该小组同学预测SO2与FeCl3溶液反应的现象为溶液由棕黄色变成浅绿色,然后开始实验。
步骤① | 配制1 mol·L-1 FeCl3溶液(未用盐酸酸化),测其pH约为1, |
FeCl3溶液显酸性的原因是_______________________(用离子方程式表示)。写出装置A中产生SO2的化学方程式:______________________。
(2)当SO2通入到FeCl3溶液至饱和时,同学们观察到的现象是溶液由棕黄色变成红棕色,没有观察到丁达尔效应。将混合液放置12小时,溶液才变成浅绿色。
【资料】[Fe(HSO3)]2+离子为红棕色,它可以将Fe3+还原为Fe2+。生成[Fe(HSO3)]2+离子的反应为可逆反应。
解释SO2与FeCl3溶液反应生成红棕色[Fe(HSO3)]2+的原因:_____________________。
写出溶液中[Fe(HSO3)]2+离子与Fe3+反应的离子方程式:_________________。
(3)为了探究如何缩短红棕色变为浅绿色的时间,该小组同学进行了步骤②③的实验。
步骤② | 往5 mL 1 mol·L-1 FeCl3溶液中通入SO2气体,溶液立即变为红棕色。微热3 min,溶液颜色变为浅绿色 |
步骤③ | 往5 mL重新配制的1 mol·L-1 FeCl3溶液(用浓盐酸酸化)中通入SO |
用铁氰化钾K3[Fe(CN)6] 溶液检验步骤②和步骤③所得溶液中的Fe2+,其现象为______________
(4)综合上述实验探究过程,可以获得的实验结论:
Ⅰ.SO2与FeCl3溶液反应生成红棕色中间产物[Fe(HSO3)]2+离子;
Ⅱ.红棕色中间产物转变成浅绿色溶液是一个较慢的过程;
Ⅲ.___________________ ___ _______。
___ _______。
科目:高中化学 来源:2016-2017学年广东省高二上期中化学卷(解析版) 题型:选择题
下列说法正确的是( )
A.氢氧化钠可用食物调整碱性的添加剂
B.棉、麻完全燃烧可以生成CO2和H2O
C.脂肪在一定条件下都能发生水解反应
D.汽油、柴油、煤油的主要成分都是碳氢化合物
查看答案和解析>>
科目:高中化学 来源:2016-2017学年安徽省高二上期中文化学卷(解析版) 题型:选择题
下列反应属于氧化还原反应的是( )
A.Na2O+H2O==2NaOH
B.H2+CuO==Cu+H2O
C.CaCO3==CaO+CO2↑
D.KOH+HNO3==KNO3+H2O
查看答案和解析>>
科目:高中化学 来源:2017届贵州省高三上半期考试化学试卷(解析版) 题型:推断题
F、G均是常见的香料,可通过下列途径合成,合成路线如下:
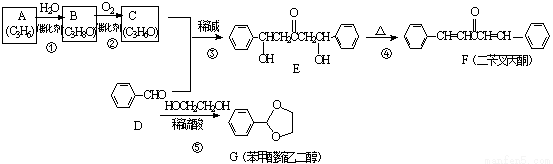
回答下列问题
(1)B的名称为 。
(2)③的反应类型是 ;④的反应类型是 。
(3)C的结构简式是 ;A加聚产物的结构简式是 。
(4)F分子中位于同一平面的碳原子最多有 个。
(5)G的芳香同分异构体中且能发生银镜反应和水解反应的异构体有 种,其中核磁共振氢谱只有四组峰的异构体结构简式为 。
(6.)参照上述合成路线,以甲醛、乙醛及 (环已酮)合成
(环已酮)合成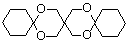 [已知HCHO是所有醛中还原性最强的(常用Ca(OH)2催化剂)] 。
[已知HCHO是所有醛中还原性最强的(常用Ca(OH)2催化剂)] 。
查看答案和解析>>
科目:高中化学 来源:2017届贵州省高三上半期考试化学试卷(解析版) 题型:选择题
四种短周期主族元素W、X、Y、Z的原子序数依次增大,W、X的简单离子具有相同电子F层结构, X的原子半径是短周期主族元素原子中最大的,W与Y同族,Z与X形成的离子化合物的水溶液呈中性。下列说法正确的是( )
A. 简单离子半径:W<X<Z B. W与X形成的化合物溶于水后溶液呈碱性
C. 气态氢化物的热稳定性:W<Y D. 最高价氧化物的水化物的酸性:Y>Zl
查看答案和解析>>
科目:高中化学 来源:2017届甘肃省高三上第二阶段考化学试卷(解析版) 题型:选择题
为增强铝的耐腐蚀性,现以铅蓄电池为外电源,以Al作阳极、Pb作阴极,电解稀硫酸,使铝表面的氧化膜增厚。反应原理如下:
电池:Pb(s)+PbO2(s)+2H2SO4(aq)=2PbSO4(s)+2H2O
电解池:2Al+3H2O Al2O3+3H2↑ 电解过程中,以下判断正确的是
Al2O3+3H2↑ 电解过程中,以下判断正确的是
电池 | 电解池 | |
A. | H+移向Pb电极 | H+移向Pb电极 |
B. | 每消耗3 mol Pb | 生成2 mol Al2O3 |
C. | 正极:PbO2+4H++2e-===Pb2++2H2O | 阳极:2Al+3H2O-6e-===Al2O3+6H+ |
D. |
|
|
查看答案和解析>>
科目:高中化学 来源:2017届甘肃省高三上第二阶段考化学试卷(解析版) 题型:选择题
向等物质的量浓度的HCl、AlCl3、NH4Cl、MgCl2混合溶液中逐滴加入1 mol·L-1的NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如图所示。下列有关说法正确的是
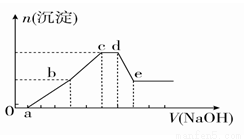
A.在0~a段加入的NaOH溶液与NH4Cl反应
B.在滴加NaOH溶液全过程中主要粒子参与反应的先后顺序是H+、Al3+、Mg2+、NH4+、Al(OH)3
C.c点溶液中溶质只有NaCl
D.在d~e段加入NaOH溶液发生反应的离子方程式为Al3++4OH-===AlO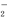 +2H2O
+2H2O
查看答案和解析>>
科目:高中化学 来源:2017届安徽省高三上学期期中化学试卷(解析版) 题型:选择题
N2和H2在催化剂表面合成氨的微观历程及能量变化的示意图如 下,用
下,用 、
、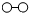 、
、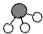 分别表示N2、H2、NH3,下列说法正确的是
分别表示N2、H2、NH3,下列说法正确的是
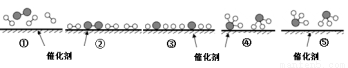
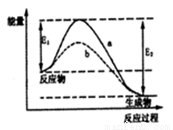
A.使用催化剂,合成氨反应放出的热量减少
B.在该过程中,N2、H2断键形成N原子和H原子
C.在该过程中,N原子和H原子形成了含有非极性键的NH3
D.合成氨反应中,反应物断键吸收能量大于生成物形成新键释放的能量
查看答案和解析>>
科目:高中化学 来源:2017届内蒙古高三上第二次月考化学试卷(解析版) 题型:选择题
已知NH3·H2O(aq)与H2SO4(aq)反应生成1 mol正盐的ΔH=-24.2 kJ·mol-1;强酸、强碱的稀溶液反应的中和热ΔH=-57.3 kJ·mol-1。则NH3·H2O在水溶液中电离的ΔH等于
A.-69.4 kJ·mol-1 B.-45.2 kJ·mol-1
C.+69.4 kJ·mol-1 D.+45.2 kJ·mol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com