
N2H4是一种高效清洁的火箭燃料。0.25 mol N2H4(g)完全燃烧生成氮气和气态水时,放出133.5 kJ热量。则下列热化学方程式中正确的是
A. N2H4+
N2H4+ O2===
O2=== N2+H2O ΔH=-267 kJ·mol-1
N2+H2O ΔH=-267 kJ·mol-1
B.N2H4(g)+O2(g)===N2(g)+2H2O(l) ΔH=-133.5 kJ·mol-1
C.N2H4(g)+O2(g)===N2(g)+2H2O(g) ΔH=+534 kJ
D.N2H4(g)+O2(g)===N2(g)+2H2O(g) ΔH=-534 kJ·mol-1
科目:高中化学 来源: 题型:
下列叙述正确的是( )
A.某有机物燃烧后产物只有CO2和H2O,可推出的结论是有机物属于烃
B.某有机物燃烧后产物只有CO2和H2O,可推出的结论是有机物属于烃的含氧衍生物
C.某有机物燃烧后产物只有CO2和H2O,通过测定有机物、CO2和H2O的质量,可确定
有机物是否含有氧
D.甲烷在同系物中含碳量最高,因而是清洁能源
查看答案和解析>>
科目:高中化学 来源: 题型:
控制适合的条件,将反应2Fe3++2I-2Fe2++I2设计成如下图所示的原电池。下列判断不正确的是 ( )
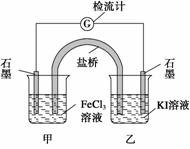
A.反应开始时,乙中石墨电极上发生氧化反应
B.反应开始时,甲中石墨电极上Fe3+被还原
C.检流计读数为零时,反应达到化学平衡状态
D.检流计读数为零后,在甲中溶入FeCl2固体,乙中的石墨电极为负极
查看答案和解析>>
科目:高中化学 来源: 题型:
将两个铂电极放置在KOH溶液中,然后分别向两极通入CH4和O2,即可产生电流。下列叙述正确的是 ( )
①通入CH4的电极为正极 ②正极的电极反应式为O2+2H2O+4e-===4OH- ③通入CH4的电极反应式为CH4+2O2+4e-===CO2+2H2O ④负极的电极反应式为CH4+10OH--8e-===CO +7H2O ⑤放电时溶液中的阳离子向负极移动 ⑥放电时溶液中的阴离子向负极移动
+7H2O ⑤放电时溶液中的阳离子向负极移动 ⑥放电时溶液中的阴离子向负极移动
A.①③⑤ B.②④⑥
C.④⑤⑥ D.①②③
查看答案和解析>>
科目:高中化学 来源: 题型:
某研究性学习小组根据反应2KMnO4+10FeSO4+8H2SO4===2MnSO4+5Fe2(SO4)3+K2SO4+8H2O设计如下原电池,其中甲、乙两烧杯中各物质的物质的量浓度均为
1 mol·L-1,溶液的体积均为200 mL,盐桥中装有饱和K2SO4溶液。
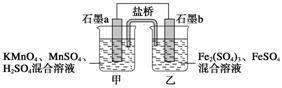
回答下列问题:
(1)此原电池的正极是石墨__________(填“a”或“b”),发生________反应。
(2)电池工作时,盐桥中的SO 移向________(填“甲”或“乙”)烧杯。
移向________(填“甲”或“乙”)烧杯。
(3)两烧杯中的电极反应式分别为
甲________________________________________________________________________;
乙________________________________________________________________________。
(4)若不考虑溶液的体积变化,MnSO4浓度变为1.5 mol·L-1,则反应中转移的电子为________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
在离子RO3n—中共有x个核外电子,R原子的质量数为A,则R原子核内含有的中子数目是
A.A-x+n+48 B.A-x+n+24
C.A-x-n-24 D.A+x-n-24
查看答案和解析>>
科目:高中化学 来源: 题型:
对于以下反应:A(s)+3B(g) 2C(g)+D(g),在一定温度、体积固定的密闭容器中进行,下列叙述中能说明上述反应达到平衡状态的是
2C(g)+D(g),在一定温度、体积固定的密闭容器中进行,下列叙述中能说明上述反应达到平衡状态的是
A.混合气体的密度不随时间变化而变化
B. 3v正(B)= v逆(D)
C.D的物质的量分数在混合气体中保持不变
D.B、C、D的分子个数之比为3∶2∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
能正确表示下列反应的离子方程式的是
A.NaOH溶液中加入铝片:Al+2OH-=AlO2-+H2↑
B.NaHCO3溶液水解:HCO3-+H2O H3O+ +CO32-
H3O+ +CO32-
C.NH4HCO3溶液与足量烧碱溶液混合:HCO3-+OH-=CO32-+H2O
D.硫酸溶液与氢氧化钡溶液混合:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C、D、E都是短周期元素,原子序数依次增大,元素B的原子价电子构型为ns2npn+2 。B、C同周期, C为周期表中电负性最大的元素,A、D同主族。A、B能形成两种液态化合物甲和乙,原子个数比分别为2∶1和1∶1,E 是地壳中含量最高的金属元素。根据以上信息回答下列问题:
⑴写出A、B、C、D、E元素符号___、___、___、___、___、
⑵B原子的电子排布图为_________________。D离子的电子排布式为______________________,甲、乙两分子中含有非极性共价键的物质的电子式是___________________,
⑶DBA中的化学键类型为____________、____________属于 化合物(填“离子”或“共价”)
⑷A的硫化物中,A原子以 杂化轨道成键,分子空间构型为 ;
(5)分别写出DBA水溶液与E、DBA与E的氧化物反应的化学方程式.
_____ ______ _______
_______ ______ _______ __
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com