
【题目】某同学按照课本实验要求,用 50mL 0.50 mol·L-1 的盐酸与 50mL 0.50 mol·L-1 的NaOH溶液在如图所示的装置中进行中和反应,通过测定反应过程中所放出的热量计算反应热。下列 说法中,不正确的是( )

A.实验过程中有一定的热量损失
B.图中实验装置缺少环形玻璃搅拌棒
C.烧杯间填满碎纸条的主要作用是固定小烧杯
D.若将盐酸体积改为 60 mL,理论上所求反应热相等
科目:高中化学 来源: 题型:
【题目】已知:2H2O(l)=2H2(g)+O2(g) ΔH=+571.0kJ/mol。以太阳能为热源分解Fe3O4,经热化学铁氧化合物循环分解水制H2的过程如下:
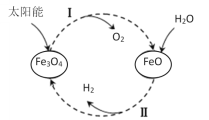
过程Ⅰ:2Fe3O4(s)=6FeO(s)+O2(g) ΔH=+313.2kJ/mol
过程Ⅱ:……
下列说法不正确的是( )
A.过程Ⅰ中每消耗232gFe3O4转移2mol电子
B.过程Ⅱ热化学方程式为:3FeO(s)+H2O(l)=H2(g)+Fe3O4(s) ΔH=-128.9kJ/mol
C.过程Ⅰ、Ⅱ中能量转化的形式依次是:太阳能→化学能→热能
D.铁氧化合物循环制H2具有成本低、产物易分离等优点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是![]()
![]() 氧化还原反应的实质是电子的转移
氧化还原反应的实质是电子的转移
![]() 若1mol气体的体积为
若1mol气体的体积为![]() ,则它一定处于标准状况下
,则它一定处于标准状况下
![]() 标准状况下,1LHCl和1L
标准状况下,1LHCl和1L![]() 的物质的量相同
的物质的量相同
![]() 溶于水得到的溶液可以导电的化合物就是电解质
溶于水得到的溶液可以导电的化合物就是电解质
![]() 利用丁达尔现象区别溶液和胶体
利用丁达尔现象区别溶液和胶体
![]() 两种物质的物质的量相同,则它们在标准状况下的体积也相同
两种物质的物质的量相同,则它们在标准状况下的体积也相同
![]() 在同温、同体积时,气体物质的物质的量越大,则压强越大
在同温、同体积时,气体物质的物质的量越大,则压强越大
![]() 同温同压下,气体的密度与气体的相对分子质量成正比
同温同压下,气体的密度与气体的相对分子质量成正比
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从海水中可以获得淡水、食盐,并可提取镁和溴等物质。
(1)海水淡化的方法有_______(填一种)。
(2)写出元素钠在元素周期表中的位置:_______。
(3)从海水中提取镁的流程如下图所示:
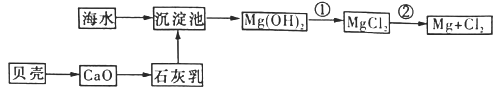
反应①的离子方程式为_______________。
反应②的化学方程式为_______________。
(4)从海水中提取溴的主要步骤是向浓缩的海水中通人氯气,将溴离子氧化,该反应的离子方程式为_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是( )
A.SO2与过量氨水反应:SO2+NH3·H2O=NH4++HSO3-
B.FeCl3溶液与SnCl2溶液反应:Fe3++Sn2+=Fe2++Sn4+
C.Cu与稀硝酸反应:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O
D.用浓盐酸与MnO2制取少量Cl2:MnO2+4H++4Cl-![]() MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(化学---选修2:化学与技术)
南海某小岛上,可利用的淡水资源相当匮乏,解放军战士为了寻找合适的饮用水源,对岛上山泉水进行分析化验,结果显示山泉水属于硬水。
(1)硬水是指含有较多______________的水,硬水加热后产生沉淀的离子方程式为:________________________________(写出生成一种沉淀物的即可) 。
(2)硬度为1°的水是指每升水含10 mg CaO或与之相当的物质(如7.1 mg MgO),已知水的硬度在8°以下的称为软水,在8°以上的称为硬水。已知岛上山泉水中c( Ca2+)=1.2×10-3 mol/L,c(Mg2+) =6×l0-4mol/L,那么此水______(填“是”或“否”)属于硬水。
(3)离子交换法是软化水的常用方法。聚丙烯酸钠是一种离子交换树脂,写出聚丙烯酸钠单体的结构简式__________________。
(4)解放军战士通常向水中加入明矾净水,请用离子方程式解释其净水原理:______________。
(5)岛上还可以用海水淡化来获得淡水。下面是海水利用电渗析法获得淡水的原理图,已知海水中含Na+、Cl-、Ca2+、Mg2+、SO42-等离子,电极为惰性电极。请分析下列问题:

①阳离子交换膜是指___________(填A或B)。
②写出通电后阳极区的电极反应式____________,阴极区的现象是:_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙为两个容积均为1 L的恒容密闭容器,向甲中充入1 mol CH4和1 mol CO2,乙中充入1 mol CH4和m mol CO2,加入催化剂,只发生反应:CH4(g)+CO2(g)![]() 2CO(g)+2H2(g),测得CH4的平衡转化率随温度的变化如图所示。下列说法正确的是( )
2CO(g)+2H2(g),测得CH4的平衡转化率随温度的变化如图所示。下列说法正确的是( )
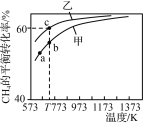
A.该反应的正反应是放热反应
B.a、b、c三点处,容器内气体总压强:p(a)<p(b)<p(c)
C.T K时,该反应的平衡常数小于12.96
D.恒温时向甲的平衡体系中再充入CO2、CH4各0.4 mol,CO、H2各1.2 mol,重新达平衡前,v(正)>v(逆)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】沼气的主要成分是CH4,还含有CO2、H2S等。Jo De Vrieze等设计了利用膜电解法脱除沼气中的CO2和H2S,并将阴极处理后气体制成高纯度生物甲烷,其流程如图所示。

(1) 需控制电解槽中阴极室pH>7,其目的是________________。
(2) 阳极室逸出CO2和________(填化学式);H2S在阳极上转化为SO42-而除去,其电极反应式为___________________。
(3) 在合成塔中主要发生的反应为:
反应Ⅰ: CO2(g)+4H2(g)=CH4(g)+2H2O(g) ΔH1
反应Ⅱ: CO2(g)+H2(g)=CO(g)+H2O(g) ΔH2
调节![]() =4,充入合成塔,当气体总压强为0.1 MPa,平衡时各物质的物质的量分数如图1所示;不同压强时,CO2的平衡转化率如图2所示:
=4,充入合成塔,当气体总压强为0.1 MPa,平衡时各物质的物质的量分数如图1所示;不同压强时,CO2的平衡转化率如图2所示:

①反应CO2(g)+CH4(g)=2CO(g)+2H2(g)的△H=________(用ΔH1、ΔH2表示)。
②图1中,200~550 ℃时,CO2的物质的量分数随温度升高而增大的原因是__________。
③图2中,相同温度下,压强越大,CO2的平衡转化率越大,其原因是___________________;在压强为10 MPa时,当温度在200~800 ℃范围内,随温度升高,CO2的平衡转化率始终减小,其原因是________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】黄铁矾法是硫酸体系中除铁的常用方法,黄铵铁矾是黄铁矾中的一种[化学式可表示为(NH4)xFey(SO4)z(OH)w,摩尔质量为480 g·mol-1]。
(1) 除去MnSO4酸性溶液中的Fe2+可向溶液中加入MnO2,充分搅拌,然后用氨水调节溶液的pH为1~3,升温到95 ℃,静置即可形成黄铵铁矾沉淀。MnO2氧化Fe2+的离子方程式为_______________________,静置形成黄铵铁矾过程中溶液的pH________(填“增大”“减小”或“不变”)。
(2) 依据下列实验和数据可确定黄铵铁矾的化学式。
①称取黄铵铁矾2.400 g,加入足量NaOH溶液充分反应后过滤,向滤液中加入足量盐酸酸化的BaCl2溶液,得到沉淀2.330 g。
②Mim Ristic等曾对黄铵铁矾进行热分解实验,其结果可用下图热重曲线表示(已知:黄铵铁矾在300 ℃前分解释放的物质为H2O,300~575 ℃之间只有NH3·H2O放出,此时残留固体只存在Fe、O、S三种元素,670 ℃以上得到的是纯净的红棕色粉末)。

根据以上实验及图中数据确定黄铵铁矾的化学式______________(写出计算过程)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com