
某密闭容器中充入等物质的量的气体A和B,一定温度下发生反应:A(g)+xB(g) 2C(g),达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率随时间变化如右图所示。下列说法中正确的是 ( )
2C(g),达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率随时间变化如右图所示。下列说法中正确的是 ( )
A.8 min时表示正反应速率等于逆反应速率
B.前20 min A的反应速率为0.051mol·L-1·min-1
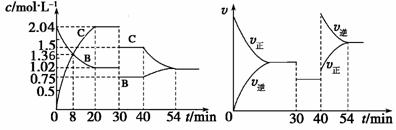 C.反应方程式中的x=1则30 min时表示增大压强
C.反应方程式中的x=1则30 min时表示增大压强
D.40 min时改变的条件是升高温度,且正反应为吸热反应
科目:高中化学 来源: 题型:
下列解释事实的方程式不准确的是( )
A.用浓盐酸检验氨:NH3+HCl===NH4Cl
B.碳酸钠溶液显碱性:CO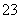 +H2OHCO
+H2OHCO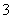 +OH-
+OH-
C.钢铁发生吸氧腐蚀时,铁作负极被氧化:Fe-3e-===Fe3+
D.长期盛放石灰水的试剂瓶内壁出现白色固体:Ca(OH)2+CO2===CaCO3↓+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
已建立化学平衡的某可逆反应,当条件改变使化学平衡向正反应方向移动时,下列叙述正确的是( )
①生成物的质量分数一定增加 ②任一生成物总量一定增加
③反应物的转化率一定增大 ④反应物的浓度一定降低
⑤正反应速率一定大于逆反应速率 ⑥一定使用催化剂
A.①②③ B.③④⑤ C.②⑤ D.④⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
已知反应mX(g)+nY(g)  qZ(g) ΔH>0,m+n>q,在恒容密闭容器中反应达到平衡时,下列说法正确的是( )
qZ(g) ΔH>0,m+n>q,在恒容密闭容器中反应达到平衡时,下列说法正确的是( )
A.升高温度,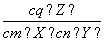 增大
增大
B.降低温度,混合气体的平均相对分子质量增大
C.通入稀有气体,压强增大,平衡向正反应方向移动
D.X的正反应速率是Y的逆反应速率的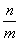 倍
倍
查看答案和解析>>
科目:高中化学 来源: 题型:
2007年诺贝尔化学奖授予德国科学家格哈德·埃特尔,以表彰他在表面化学研究领域作出的开拓性贡献。
(1)有人认为:该研究可以提高合成氨反应在铁催化剂表面进行的效率,从而提高原料的转化率。你是否认同他的观点________(填“是”或“否”)。理由是
。
(2)合成氨反应:N2(g)+3H2(g) 2NH3(g),在某温度时,K=0.4。
2NH3(g),在某温度时,K=0.4。
①若出现下列状态,反应将向哪个方向进行以达到平衡状态(在后面空白处填“向左进行”、“向右进行”或“已达平衡状态”)?
(A)c(N2)=c(H2)=1 mol/L,c(NH3)=0.5 mol/L, 。
(B)c(N2)=0.3 mol/L,c(H2)=0.1 mol/L,c(NH3)=0.03 mol/L, 。
②若该反应升高温度再达到平衡时,K为0.2,则正反应为________热反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
某温度时,在一个容积为2 L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示。根据图中数据,试填写下列空白:
(1)该反应的化学方程式为____________________________________。
(2)反应开始至2 min,气体Z的反应速率为_____________________。
(3)若X、Y、Z均为气体,反应达到平衡时:
①压强是开始时的________倍;
 ②若此时将容器的体积缩小为原来的
②若此时将容器的体积缩小为原来的 倍,达到平衡时,容器内温度将升高(容器不与外界进行热交换),则该反应的正反应为________反应(填“放热”或“吸热”)。
倍,达到平衡时,容器内温度将升高(容器不与外界进行热交换),则该反应的正反应为________反应(填“放热”或“吸热”)。
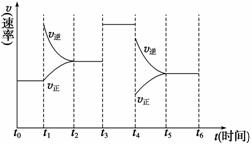
(4)若上述反应在2 min后的t1~t6内反应速率与反应时间图像如右,在每一时刻均改变一个影响反应速率的因素,则( )
A.在t1时增大了压强 B.在t3时加入了催化剂
C.在t4时降低了温度 D.t2~t3时X的转化率最高
查看答案和解析>>
科目:高中化学 来源: 题型:
为探究NaHCO3、Na2CO3与1 mol·L-1盐酸反应设两反应分别是反应Ⅰ、反应Ⅱ)过程中的热效应,进行实验并测得如下数据:
| 序号 | 液体 | 固体 | 混合前温度 | 混合后最高温度 |
| ① | 35 mL水 | 2.5 g NaHCO3 | 20 ℃ | 18.5 ℃ |
| ② | 35 mL水 | 3.2 g Na2CO3 | 20 ℃ | 24.3 ℃ |
| ③ | 35 mL盐酸 | 2.5 g NaHCO3 | 20 ℃ | 16.2 ℃ |
| ④ | 35 mL盐酸 | 3.2 g Na2CO3 | 20 ℃ | 25.1 ℃ |
下列有关说法正确的是 )。
A.仅通过实验③即可判断反应Ⅰ是吸热反应
B.仅通过实验④即可判断反应Ⅱ是放热反应
C.通过实验可判断出反应Ⅰ、Ⅱ分别是吸热反应、放热反应
D.通过实验可判断出反应Ⅰ、Ⅱ分别是放热反应、吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
某研究性学习小组在网上收集到信息:钠、镁等活泼金属都能在CO2气体中燃烧。
他们对钠在CO2气体中燃烧后得到的白色产物进行了如下探究:
【实验操作】 将燃烧的钠迅速伸入装满CO2的集气瓶中,钠在其中继续燃烧,反应后冷却,瓶底有黑色颗粒,瓶壁上附着白色物质。
【提出假设】
假设1:白色物质是Na2O。
假设2:白色物质是Na2CO3。
假设3:白色物质是Na2O和Na2CO3的混合物。
【设计方案】 该小组对燃烧后生成的白色物质进行如下探究:
| 实验方案 | 实验操作 | 实验现象 | 结论 |
| 方案1 | 取少量白色物质于试管中,加入适量水,振荡,样品全部溶于水,向其中加入无色酚酞试液 | 溶液变成红色 | 白色物质为Na2O |
| 方案2 | ①取少量白色物质于试管中,加入适量水,振荡,样品全部溶于水,向其中加入过量的CaCl2溶液。 ②静置片刻,取上层清液于试管中,滴加无色酚酞试液 | ①出现白色沉淀。 ②无明显现象 | 白色物质为Na2CO3 |
请回答下列问题:
(1)写出金属镁与二氧化碳反应的化学方程式:____________________________________________________
____________________________________________________。
(2)甲同学认为方案1得到的结论不正确,其理由是____________________________________________________
____________________________________________________。
(3)乙同学认为方案2得到的结论正确,白色物质为____________________________________________________。
(4)钠在二氧化碳中燃烧的化学反应方程式为____________________________________________________
____________________________________________________。
(5)丙同学认为白色物质有可能是氢氧化钠。你是否同意丙同学的观点,并简述理由:____________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
某校高三同学高考前重做以下两个课本实验,请你回答实验过程中的相关问题:
(1)铝热反应实验:取磁性氧化铁粉按课本中的实验装置(如图)进行铝热反应,将反应后所得“铁块”溶于盐酸,向反应后的溶液中滴加KSCN溶液,发现溶液变血红色。
①出现这种现象的原因,除了因“铁块”中可能混有没反应完的磁性氧化铁外,还有一种可能原因是__________________。
②若要证明反应所得“铁块”中含有金属铝,可用____________(填化学式)溶液,所发生反应的离子方程式为__________________。
(2)化学反应速率影响因素的探究实验:
KI在经酸化的溶液中被空气氧化的反应式为4H++4I-+O2===2I2+2H2O。该反应的速率受温度、酸度、溶剂、试剂浓度等影响,可用淀粉与碘的显色反应来观测该反应的反应速率。已知,淀粉与碘的显色反应在温度升高时灵敏度会降低,高于75 ℃则不能显色;淀粉浓度越高显色越灵敏、颜色也越深。
实验小组拟用0.8 mol·L-1 KI溶液、0.1 mol·L-1 H2SO4溶液、淀粉溶液等来探究温度、酸度对上述反应速率的影响,他们做了A、B、C三组实验,部分实验数据如下表:
| 编 号 | 温度 /℃ | H2SO4 体积 /mL | KI溶液 体积/mL | H2O体 积/mL | 淀粉溶液 /mL | 出现 蓝色 时间 /s |
| A | 39 | 10 | 5 | 5 | 1 | 5 |
| B | TB | 10 | 5 | 5 | 1 | 没出 现蓝 色 |
| C | 5 | 10 | 5 | 5 | 1 | 39 |
| D | t |
①为确保A组实验在39 ℃下进行,应采用的控温操作方法是______________________。
②A、B、C三组实验时,都加入了5 mL水,其目的是______________。
③B组实验中“没出现蓝色”,原因是______________。
④请你为小组设计D组实验方案(在表格空白处填入你设计的5个数据),以帮助小组完成探究目标。
⑤根据你设计的实验数据,请你预测一个t值,并写出与你预测相对应的探究实验结论____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com