
【题目】高锰酸钾是重要的氧化剂。回答下列问题:
(1)实验室常用高锰酸钾制备氧气。
①该反应的还原产物是___(写化学式),每生成1gO2转移___mol电子。
②高锰酸钾完全分解后,将固体生成物溶于水后过滤,向滤液中通入过量的二氧化碳。充分反应后过滤,得到二氧化锰,将滤液再经过重结晶分离,可得到高锰酸钾和碳酸氢钾。写出上述过程发生反应的化学方程式:___。
(2)实验室常用硫酸酸化的草酸(H2C2O4,二元弱酸)溶液滴定KMnO4溶液,测定KMnO4溶液浓度。步骤如下:
I.将-定量的高锰酸钾加入烧杯中,倒入蒸馏水使其溶解;
II.取ag草酸晶体(H2C2O4·2H2O,摩尔质量126g·mol-1)溶于水配成250mL溶液,取25.00mL溶液置于锥形瓶中,加入适量稀H2SO4酸化,再用KMnO4溶液滴定至终点,重复滴定两次,平均消耗VmLKMnO4溶液。
①高锰酸钾溶液盛放在___(填“酸式”或“碱式”)滴定管中。
②滴定到达终点的现象是___。
③该KMnO4溶液的物质的量浓度为___mol·L-1(用相关字母表示)。
【答案】K2MnO4和MnO2 0.125 3K2MnO4+4CO2+2H2O=2KMnO4+ MnO2↓+4KHCO3 酸式 加入最后一滴高锰酸钾溶液,溶液变为浅红色,且半分钟内不褪色 ![]()
【解析】
(1)①高锰酸钾受热分解生成锰酸钾、二氧化锰和氧气,反应方程式为:2KMnO4![]() K2MnO4+ MnO2+ O2↑,根据方程式判断;
K2MnO4+ MnO2+ O2↑,根据方程式判断;
②高锰酸钾完全分解后,将固体生成物溶于水后过滤,滤液为锰酸钾溶液,向滤液中通入过量的二氧化碳,产物为二氧化锰、高锰酸钾和碳酸氢钾;
(2)①高锰酸钾具有强氧化性,能腐蚀橡胶,应盛放在酸式滴定管中;
②高锰酸钾与草酸反应完毕,加入最后一滴高锰酸钾溶液,溶液变为浅红色,且半分钟内不褪色;
③草酸与高锰酸钾反应的离子反应为:5H2C2O4+2MnO4-+6H+=10CO2↑+2Mn2++8H2O,根据草酸与高锰酸钾的关系进行计算。
(1)①高锰酸钾受热分解生成锰酸钾、二氧化锰和氧气,反应方程式为:2KMnO4![]() K2MnO4+ MnO2+ O2↑,反应中 Mn元素的化合价从+7价降低到+6、+4价,还原产物为K2MnO4和MnO2,生成1mol O2电子转移4mol,因此生成1gO2转移的电子的物质的量为
K2MnO4+ MnO2+ O2↑,反应中 Mn元素的化合价从+7价降低到+6、+4价,还原产物为K2MnO4和MnO2,生成1mol O2电子转移4mol,因此生成1gO2转移的电子的物质的量为![]() mol=0.125mol;
mol=0.125mol;
②高锰酸钾完全分解后,将固体生成物溶于水后过滤,滤液为锰酸钾溶液,向滤液中通入过量的二氧化碳,产物为二氧化锰、高锰酸钾和碳酸氢钾,反应的方程式为:3K2MnO4+4CO2+2H2O=2 KMnO4+ MnO2↓+4KHCO3;
(2)①高锰酸钾具有强氧化性,能腐蚀橡胶,应盛放在酸式滴定管中;
②高锰酸钾与草酸反应完毕,加入最后一滴高锰酸钾溶液,溶液变为浅红色,且半分钟内不褪色即达到滴定终点;
③ag草酸晶体溶于水配成250mL溶液,取出25.00mL溶液,含有溶质![]() =
=![]() mol,根据关系5H2C2O4~2KMnO4可知KMnO4的物质的量为
mol,根据关系5H2C2O4~2KMnO4可知KMnO4的物质的量为![]() ×
×![]() =
=![]() mol,KMnO4溶液的物质的量浓度c=
mol,KMnO4溶液的物质的量浓度c=![]() =
= mol/L=
mol/L=![]() mol/L。
mol/L。


科目:高中化学 来源: 题型:
【题目】化学环分解氯化铵的纯碱和氯乙烯集成清洁工艺如下:

(1)“释氨反应”步骤可能发生的化学反应:
NH4Cl(s)≒ NH3(g)+HCl(g) ΔH=163.57 kJ/mol
MgO(s)+ HCl(g) ≒ MgOHCl(s) ΔH=-102.23 kJ/mol
则总反应NH4Cl(s)+MgO(s)≒NH3(g)+MgOHCl(s) ΔH=____kJ/mol
(2)“释氯反应”可能的化学反应有:
i. MgOHCl(s)≒MgO(s)+ HCl(g) ΔH=+97.50 kJ/mol
ii. MgOHCl(s)+ HCl(g)≒MgCl2(s)+H2O(g) ΔH=+2.89 kJ/mol
iii. MgCl2(s)+ H2O(g)=MgO(s)+2HCl(g) ΔH=+94.61 kJ/mol
图为“释氯反应”在不同温度下各组分的平衡组成,回答下列问题
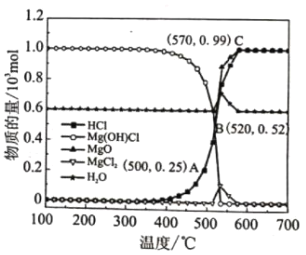
①应选择的最佳反应温度是___________
②500°C时,释氯反应器的压强为P,计算该温度下反应i的平衡常数Kp=___________ (Kp为以分压表示的平衡常数)
③结合平衡移动原理,原料气增加水蒸气的目的是___________
(3)“氯乙烯反应”中,![]() (g)+HCl(g)
(g)+HCl(g)![]() CH2=CHCl(g)的反应机理如图,其中吸附在催化剂表面的物种用*标注
CH2=CHCl(g)的反应机理如图,其中吸附在催化剂表面的物种用*标注
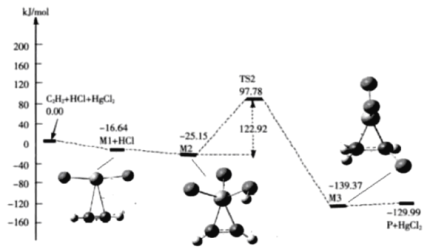
①碳碳叁键的键能:M1_____ ![]() (填“>”或“<”)
(填“>”或“<”)
②“M2→M3”的化学方程式为__________
③该反应的决速步骤为__________
(4)下列有关该工艺的说法不正确的是______(填标号)
A.可循环利用的物质有NH3、MgO、HCl
B.“石灰窑”和“纯碱反应”的副产物可实现资源化利用
C.利用MgO作为吸附剂可有效实现NH3与HCl分离
D.减少了从氯碱工业的产品获取HCl的电能消耗
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤气化的一种方法是在气化炉中给煤炭加氢,发生的主要反应为 C(s)+2H2(g) ![]() CH4(g)。在VL 的容器中投入 amol 碳(足量),同时通入 2amolH2,控制条件使其发生上述反应,实验测得碳的平衡转化率随压强及温度的变化关系如图所示。下列说法正确的是( )
CH4(g)。在VL 的容器中投入 amol 碳(足量),同时通入 2amolH2,控制条件使其发生上述反应,实验测得碳的平衡转化率随压强及温度的变化关系如图所示。下列说法正确的是( )
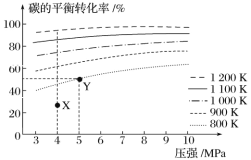
A.在 4MPa、1200K 时,图中 X 点 v 正(H2)<v 逆(H2)
B.在 5MPa、800K 时,该反应的平衡常数为![]()
C.上述正反应为吸热反应
D.工业上维持 6MPa、1000K 而不采用 10MPa、1000K,主要是因为前者碳的转化率高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于各图象的解释或结论正确的是![]()
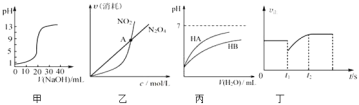
A.图甲表示用![]() 溶液滴定
溶液滴定![]()
![]()
![]() 醋酸溶液的滴定曲线
醋酸溶液的滴定曲线
B.由乙可知:对于恒温恒容条件下的反应![]() ,A点为平衡状态
,A点为平衡状态
C.由丙可知:同温度、同浓度的NaA溶液与NaB溶液相比,其pH前者小于后者
D.图丁表示反应![]() ,
,![]() 时刻减小了压强
时刻减小了压强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(NH4)2SO3氧化是氨法脱硫的重要过程。某小组在其他条件不变时,分别研究了一段时间内温度和(NH4)2SO3初始浓度对空气氧化(NH4)2SO3速率的影响,结果如图。下列说法不正确的是

A.60℃之前,氧化速率增大与温度升高化学反应速率加快有关
B.60℃之后,氧化速率降低可能与O2的溶解度下降及(NH4)2SO3受热易分解有关
C.(NH4)2SO3初始浓度增大到一定程度,氧化速率变化不大,与SO32-水解程度增大有关
D.(NH4)2SO3初始浓度增大到一定程度,氧化速率变化不大,可能与O2的溶解速率有关
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下列四个图像的说法中正确的是
A. 图① 表示可逆反应“CO(g)+H2O(g)
表示可逆反应“CO(g)+H2O(g)![]() CO2(g)+H2(g)”中的ΔH大于0
CO2(g)+H2(g)”中的ΔH大于0
B. 图②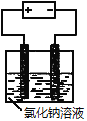 以石墨为电极电解氯化钠稀溶液的电解池中,阴、阳极产生气体体积之比一定为1∶1
以石墨为电极电解氯化钠稀溶液的电解池中,阴、阳极产生气体体积之比一定为1∶1
C. 图③ 表示碳酸钠溶液加水稀释时溶液的pH值变化
表示碳酸钠溶液加水稀释时溶液的pH值变化
D. 图④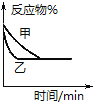 表示压强对可逆反应2A(g)+2B(g)
表示压强对可逆反应2A(g)+2B(g)![]() 3C(g)+D(s)的影响,乙的压强大
3C(g)+D(s)的影响,乙的压强大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在一个2 L的密闭容器中,加入4 mol A和2 mol B进行如下反应3A(g)+2B(g) ![]() 4C(s)+2D(g),反应一段时间后达到平衡,测得生成1.6 mol C,则下列说法正确的是( )
4C(s)+2D(g),反应一段时间后达到平衡,测得生成1.6 mol C,则下列说法正确的是( )
A. 该反应的化学平衡常数表达式是![]()
B. 此时,B的平衡转化率是40%
C. 增大该体系的压强,化学平衡常数增大
D. 增加B,B的平衡转化率增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】今有室温下四种溶液,有关叙述不正确的是
序号 | ① | ② | ③ | ④ |
pH | 11 | 11 | 3 | 3 |
溶液 | 氨水 | 氢氧化钠溶液 | 醋酸 | 盐酸 |
A. ③④中分别加入适量的醋酸钠晶体后,两溶液的pH均增大
B. ②③两溶液等体积混合,所得溶液中c(H+)>c(OH-)
C. 分别加水稀释10倍,四种溶液的pH①>②>④>③
D. V1L④与V2L①溶液混合后,若混合后溶液pH=7,则V1<V2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(I)下表是25℃时某些弱酸的电离平衡常数。
化学式 | CH3COOH | HClO | H2CO3 | H2C2O4 |
Ka | Ka=1.8×10-5 | Ka=3.0×10-8 | Ka1=4.1×10-7 Ka2=5.6×10-11 | Ka1=5.9×10-2 Ka2=6.4×10-5 |
(1)H2C2O4与含等物质的量的KOH的溶液反应后所得溶液呈酸性,该溶液中各离子浓度由大到小的顺序为__。
(2)pH相同的NaClO和CH3COOK溶液,其溶液的物质的量浓度的大小关系是(填“>”、“<”或“=”):CH3COOK_____NaClO,两溶液中:[c(Na+)-c(ClO-)]_____[c(K+)-c(CH3COO-)]。
(3)碳酸钠溶液中滴加少量氯水的离子方程式为__________。
(II)H3PO2也可用电渗析法制备。“四室电渗析法”工作原理如图所示(阳膜和阴膜分别只允许阳离子、阴离子通过):
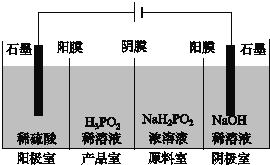
(4)写出阳极的电极反应式_________。
(5)分析产品室可得到H3PO2的原因___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com