
【题目】将13.0 g锌投入250mL某浓度的盐酸中,锌和盐酸恰好完全反应。求:
(1)反应中生成的H2在标准状况下的体积。__
(2)所用盐酸中HCl的物质的量浓度。_____________
(3)需用多少体积的36.5%的浓盐酸(ρ =1.20 g/mL)来配置上述盐酸。_________
【答案】4.48L 1.60 mol / L 33.3 mL
【解析】
根据n=![]() 计算13.0g锌的物质的量,根据方程式Zn+2HCl=ZnCl2+H2↑,计算n(H2)、n(HCl),根据V=nVm计算氢气的体积,再根据c=
计算13.0g锌的物质的量,根据方程式Zn+2HCl=ZnCl2+H2↑,计算n(H2)、n(HCl),根据V=nVm计算氢气的体积,再根据c=![]() 计算盐酸的物质的量浓度。
计算盐酸的物质的量浓度。
根据公式c=![]() ,然后抓住溶液配置过程中溶质的物质的量不变来计算。
,然后抓住溶液配置过程中溶质的物质的量不变来计算。
13.0g锌的物质的量![]() =0.2mol,因为和盐酸恰好完全反应,设生成的氢气的物质的量为xmol,反应掉的盐酸的物质的量为ymol,则有:
=0.2mol,因为和盐酸恰好完全反应,设生成的氢气的物质的量为xmol,反应掉的盐酸的物质的量为ymol,则有:
Zn+2HCl=ZnCl2+H2↑
12 1
0.2mol ymolxmol则有:![]() =
=![]() =
=![]()
计算得出x=0.2mol,y=0.4mol;
(1) 生成氢气的物质的量为0.2mol,在标况下的体积V=nVm=0.2mol![]() 22.4mol/L=4.48L,
22.4mol/L=4.48L,
故答案为:4.48L;
(2)溶液中盐酸的物质的量为0.4mol,故物质的量浓度c=![]() =1.60mol/L,
=1.60mol/L,
故答案为:1.60 mol / L;
(3) 设体积为VL,则1.60![]() 0.25=
0.25=![]() V,所以V=0.0333L=33.3mL,
V,所以V=0.0333L=33.3mL,
故答案为:33.3mL。


科目:高中化学 来源: 题型:
【题目】将50g溶质质量分数为w1,物质的量浓度为c1 的较浓氨水沿玻璃棒加人到u mL水中,稀释后得到溶质质量分数为w2,物质的量浓度为c2的稀氨水。若c1 =2c2,则:
A. w1>2w2,u>50 B. w1<2w2,u<50 C. w1=2w2,u<50 D. w1<2w2,u>50
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铍铜是力学、化学综合性能良好的合金,广泛应用于制造高级弹性元件。以下是从某废旧铍铜元件(含BeO25%、CuS71%、少量FeS和SiO2)中回收铍和铜两种金属的流程

已知:I.铍、铝元素处于周期表中的对角线位置,化学性质相似
Ⅱ.常温下: Ksp[Cu(OH)2]=2.2×10-20 Ksp[Fe(OH)3]=4.0×10-38 K sp[Mn(OH)2]=2.1×10-13
(1)滤液A的主要成分除NaOH外,还有______________ (填化学式)
写出反应I中含铍化合物与过量盐酸反应的离子方程式____________________________
(2)①溶液C中含NaCl、BeCl2和少量HCl,为提纯BeCl2,选择合理步骤并排序______________。
a加入过量的 NaOH b.通入过量的CO2 c加入过量的氨水
d.加入适量的HCl e.过滤 f洗涤
②从BeCl2溶液中得到BeCl2固体的操作是____________________________。
(3)①MnO2能将金属硫化物中的硫元素氧化为单质硫,写出反应Ⅱ中CuS发生反应的化学方程式________________________________________________________。
②若用浓HNO3溶解金属硫化物,缺点是______________ (任写一条)。
(4)溶液D中含c(Cu2+)=2.2mol·L-1、c(Fe3+)=0.008mol·L-1、c(Mn2+)=0.01mol·L-1,逐滴加入稀氨水调节pH可依次分离,首先沉淀的是______________ (填离子符号),为使铜离子开始沉淀,常温下应调节溶液的pH值大于______________。
(5)取铍铜元件1000g,最终获得Be的质量为81g,则产率是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课题组以纳米Fe2O3作为电极材料制备锂离子电池(另一极为金属锂和石墨的复合材料),通过在室温条件下对锂离子电池进行循环充放电,成功地实现了对进性的可逆调控.如图,下列说法正确的是( )

A. 该电池可以用NaOH溶液为电解质溶液
B. 放电时电池正极的电极反应式为Fe2O3+6Li++6e-═3Li2O+2Fe
C. 充电时,Fe作为阴极,电池不被磁铁吸引
D. 磁铁的主要成分是Fe3O4,其既可吸引铁,也可吸引Fe2O3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质含有的氧原子数最多的是
A. 80 g O3的气体 B. 0.5 mol CuSO4·5H2O晶体
C. 9.03×1023个CO2分子 D. 标准状况下 67.2 L NO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在b L Al2(SO4)3和(NH4)2SO4的混合溶液中加入a mol BaCl2,恰好使溶液中的SO42-﹣离子完全沉淀;如加入足量强碱并加热可得到c mol NH3,则原溶液中的Al3+浓度(mol/L)为
A. (2a-c)/b B. (2a-c)/2b C. (2a-c)/3b D. (2a-c)/6b
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知1molSiO2含有4mol Si—O。有关键能数据如表,晶体硅在氧气中燃烧的热化学方程式:Si(s)+O2(g)=SiO2(s);ΔH=-989.2kJ·mol-1,则表中x的值为
化学键 | Si—O | O=O | Si—Si |
键能/kJ·mol-1 | x | 498.8 | 176 |
A. 460 B. 920 C. 1165.2 D. 423.3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是一个化学过程的示意图:
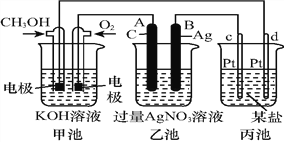
请回答:
(1)图中甲池是______装置,其中OH-移向_________极(填“CH3OH”或“O2”)。
(2)写出通入CH3OH电极的电极反应式:_______________________________。
(3)向乙池两电极附近滴加适量紫色石蕊试液,附近变红的电极为_____极(填“A”或“B”),
并写出此电极的电极反应式:______________________。
(4)乙池中反应的离子方程式为________________________。
(5)当乙池中B(Ag)极质量增加5.40 g时,乙池c(H+)是_______(若乙池中溶液为500 mL);此时丙池某电极析出1.60 g某金属,则丙中的某盐溶液可能是_________(填序号)。
A.MgSO4 B.CuSO4 C.NaCl D.AgNO3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com