
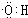 ,D中官能团的名称为羧基.
,D中官能团的名称为羧基. 2CH3CHO+2H2O.
2CH3CHO+2H2O. CH3COOCH2CH3+H2O.
CH3COOCH2CH3+H2O.
分析 A是一种气态烃,在标准状况下的密度是1.25g/L,摩尔质量=1.25g/L×22.4L/mol=28g/mol,其产量是衡量一个国家石油化工发展水平,则A为CH2=CH2;B氧化生成C、C氧化生成D,B和D都是生活中常见的有机物,结构D的分子式可知,B为CH3CH2OH,C为CH3CHO,D为CH3COOH,故反应①是乙烯与水发生加成反应生成CH3CH2OH,CH3CH2OH和CH3COOH在浓硫酸作用下发生酯化反应生成乙酸乙酯,则F为CH3COOCH2CH3).乙烯与溴发生加成反应生成1,2-二溴乙烷.
在乙酸乙酯的制备实验中,装药品的顺序为:先加入酒精,再加入浓硫酸,冷却后加入乙酸.反应中浓硫酸其催化剂、吸水剂作用;用饱和的碳酸钠溶液吸收乙酸乙酯中的乙酸与乙醇,降低乙酸乙酯的溶解度,便于分层.
解答 解:A是一种气态烃,在标准状况下的密度是1.25g/L,摩尔质量=1.25g/L×22.4L/mol=28g/mol,其产量是衡量一个国家石油化工发展水平,则A为CH2=CH2;B氧化生成C、C氧化生成D,B和D都是生活中常见的有机物,结构D的分子式可知,B为CH3CH2OH,C为CH3CHO,D为CH3COOH,故反应①是乙烯与水发生加成反应生成CH3CH2OH,CH3CH2OH和CH3COOH在浓硫酸作用下发生酯化反应生成乙酸乙酯,则F为CH3COOCH2CH3),乙烯与溴发生加成反应生成1,2-二溴乙烷,
(1)由上述分析可知,A的结构式为CH2=CH2;B为CH3CH2OH,含有官能团为羟基,羟基的电子式为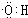 ;D为CH3COOH,含有羧基,
;D为CH3COOH,含有羧基,
故答案为:CH2=CH2;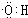 ;羧基;
;羧基;
(2)反应①是乙烯与水发生加成反应生成乙醇;
反应③是乙烯与溴发生加成反应生成1,2-二溴乙烷,反应方程式为:CH2=CH2+Br2→CH2BrCH2Br,
故答案为:加成反应;CH2=CH2+Br2→CH2BrCH2Br;
(3)反应②在Cu做催化剂的条件下进行,反应的化学方程式为2CH3CH2OH+O2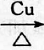
故答案为:2CH3CH2OH+O2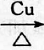
(4)D为CH3COOH,乙酸与碳酸氢钠溶液反应生成乙酸钠与二氧化碳与水,反应的离子方程式为:CH3COOH+HCO3-→CH3COO-+H2O+CO2↑,
故答案为:CH3COOH+HCO3-→CH3COO-+H2O+CO2↑;
(5)在乙酸乙酯的制备实验中,用饱和的碳酸钠溶液吸收乙酸乙酯中的乙酸与乙醇,降低乙酸乙酯的溶解度,便于分层,制备乙酸乙酯的反应方程式为:CH3CH2OH+CH3COOH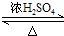 CH3COOCH2CH3+H2O,
CH3COOCH2CH3+H2O,
故答案为:Na2CO3;溶解乙醇,反应乙酸,降低乙酸乙酯的溶解度;CH3CH2OH+CH3COOH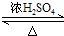 CH3COOCH2CH3+H2O.
CH3COOCH2CH3+H2O.
点评 本题考查有机物推断、乙酸乙酯的实验室制备,掌握烯与醇、醛、羧酸之间的转化关系是关键,难度不大,注意基础知识的理解掌握.


科目:高中化学 来源: 题型:解答题
| 操作步骤 | 现象 |
| 步骤1:向2mL 0.005mol•L-1 AgNO3溶液中加入2mL 0.005mol•L-1KSCN溶液,静置. | 出现白色沉淀. |
| 步骤2:取1mL上层清液于试管中,滴加1滴2mol•L-1 Fe(NO3)3溶液. | 溶液变红色. |
| 步骤3:向步骤2的溶液中,继续加入5滴3mol•L-1AgNO3溶液. | 出现白色沉淀,溶液红色变浅. |
| 步骤4:向步骤1余下的浊液中加入5滴3mol•L-1KI溶液. | 出现黄色沉淀. |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 路线:
路线:
 .
.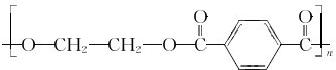 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将Ca(ClO)2、Na2SO3、FeCl3溶液蒸干可得到原溶质 | |
| B. | 因Cl2的氧化性强于I2的氧化性,所以置换反应I2+2NaClO3═2NaIO3+Cl2不能发生 | |
| C. | 在新制氯水中各微粒浓度的关系为:2c(Cl2)=c(ClO?)+c(Cl?)+c(HClO) | |
| D. | 用1L 0.2 mol•L-1NaOH溶液分别吸收0.1molSO2、0.1mol CO2,所得的两种溶液中酸根离子浓度大小关系是:c(SO32- )>c(CO32-)>c(HCO3-)>c(HSO3-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素 | T | X | Y | Z |
| 信息 | 原子最外层电子数比内层电子数多4 | 最高正价为+5,单质性质很稳定 | L层电子数比其他电子层电子数之和多5 | 单质、最高价氧化物(R)及对应的水化物均可与Y的最高价氧化物对应的水化物(M)反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在Na3A、Na2HA、NaH2A三溶液中,离子种类不相同 | |
| B. | 在溶质物质的量相等的Na3A、Na2HA、NaH2A三溶液中阴离子总数相等 | |
| C. | 在NaH2A溶液中一定有c(Na+)+c(H+)=c(OH-)+c(H2A-)+c(HA2-)+c(A3-) | |
| D. | 在Na3A溶液中一定有:c(H+)=c(OH-)-c(HA2-)-2c(H2A-)-3c(H3A) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解精炼铜的过程中,每转移NA个电子时,阳极溶解铜的质量为32g | |
| B. | 1 mol Na2O2固体中含离子总数为4NA | |
| C. | 1mol羟基与17 g NH3所含电子数之比为9:10 | |
| D. | 一定温度下,1 L 0.5 mol•L-1 NH4Cl溶液与2 L 0.25 mol•L-1 NH4Cl溶液含NH${\;}_{4}^{+}$的物质的量相同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com