
| A. | 淀粉、纤维素、蛋白质均属于天然高分子化合物,水解产物都只有一种 | |
| B. | 油脂在碱性条件下水解属于皂化反应,酸性条件下的水解产物为甘油和高级脂肪酸 | |
| C. | 用pH计、电导率仪(一种测量溶液导电能力的仪器)均可监测乙酸乙酯的水解程度 | |
| D. | TiCl4+(x+2)H2O$\stackrel{△}{?}$TiO2•xH2O↓+4HCl 属于水解反应 |
分析 A.蛋白质的最终水解产物为氨基酸,产物不能确定;
B.油脂在碱性条件下水解为高级脂肪酸盐和甘油,又称皂化反应;油脂在酸性条件下水解为甘油和高级脂肪酸;
C.乙酸乙酯水解生成乙酸和乙醇,只有乙酸为电解质,且乙酸电离显酸性;
D.TiCl4水解生成TiO2•xH2O,同时生成HCl.
解答 解:A.淀粉、纤维素的最终水解产物均为葡萄糖,而蛋白质的最终水解产物一般为多种氨基酸,由蛋白质结构确定,故A错误;
B.油脂在碱性条件下水解属于皂化反应,在碱性条件下水解为高级脂肪酸盐和甘油,酸性条件下的水解产物为甘油和高级脂肪酸,故B正确;
C.乙酸乙酯水解生成乙酸和乙醇,只有乙酸为电解质,且乙酸电离显酸性,则乙酸浓度越大,酸性越强,导电能力也越强,所以用pH计、电导率仪(一种测量溶液导电能力的仪器)均可监测乙酸乙酯的水解程度,故C正确;
D.TiCl4水解生成TiO2•xH2O,同时生成HCl.方程式为:TiCl4+(x+2)H2O$\stackrel{△}{?}$TiO2•xH2O↓+4HCl,属于水解反应,故D正确;
故选A.
点评 本题考查糖类,油脂,蛋白质的性质,弱电解质的电离和水解反应,侧重学生分析能力及知识迁移应用能力的考查,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 0.30 | B. | 0.35 | C. | 0.40 | D. | 0.50 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Sn2+、Fe2+、Ce3+ | B. | Fe2+、Ce3+、Sn2+ | C. | Fe2+、Sn2+、Ce3+ | D. | Ce3+、Fe2+、Sn2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl-、K+、HCO3-、Ca2+ | B. | OH-、NH4+、Mg2+、HCO3- | ||
| C. | SO32-、H+、Cl-、NO3- | D. | Na+、SiO32-、H+、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
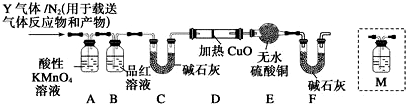
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入Al能放出H2的溶液中:K+、Na+、CO32-、NO3- | |
| B. | 滴入甲基橙变黄的溶液中:Cu2+、Al3+、SO42-、NO3- | |
| C. | 能使碘化钾淀粉试纸变蓝的溶液中:Na+、NH4+、S2-、Br- | |
| D. | 水电离出的c(H+)=1×10-12 mol•L-1的溶液中:Na+、Mg2+、Cl-、SO42- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com