
| 物质 | 杂质 | 试剂 | 方法 | |
| A | 氯化铁溶液 | 氯化亚铁 | 过量铁粉 | 过滤 |
| B | 二氧化碳 | 二氧化硫 | 饱和NaHCO3溶液 | 洗气 |
| C | 二氧化硅 | 氧化铝 | 氨水 | 过滤 |
| D | 氯化钠溶液 | 碘化钠 | 四氯化碳 | 萃取 |
| A. | A | B. | B | C. | C | D. | D |
科目:高中化学 来源: 题型:选择题
| A. | 将4 g NaOH溶解在1L蒸馏水中 | |
| B. | 用托盘天平称量5.85g NaCl固体溶于蒸馏水,配成1000mL溶液 | |
| C. | 常温常压下,将11.2L HCl气体溶于蒸馏水,配成500mL溶液 | |
| D. | 取50 mL 0.5mol/L 的KNO3溶液用蒸馏水稀释,配成250mL 溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 41.3% | B. | 8.7% | C. | 1.74% | D. | 2.14% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
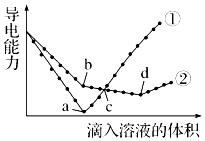 常温下,在两份相同的 Ba(OH)2溶液中,分别滴入物质的量浓度相等的H2SO4、NaHSO4溶液,其导电能力随滴入溶液体积变化的曲线如图所示.下列分析不正确的是( )
常温下,在两份相同的 Ba(OH)2溶液中,分别滴入物质的量浓度相等的H2SO4、NaHSO4溶液,其导电能力随滴入溶液体积变化的曲线如图所示.下列分析不正确的是( )| A. | ①代表滴加H2SO4溶液的变化曲线 | B. | b点,水电离产生的c(H+)<10-7mol/L | ||
| C. | c点,两溶液中含有相同量的 OH- | D. | a、d两点对应的溶液均显中性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 足量铁在氯气中反应,1mol铁失去的电子数为3NA | |
| B. | 6.4g Cu与足量硫充分反应后,转移电子数为0.2NA | |
| C. | 密闭容器中2mol NO与1mol O2充分反应后,产物的分子数为NA | |
| D. | 常温常压下,0.1mol NH3与0.1mol HCl充分反应后所得产物含0.1NA个分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 容器编号 | 起始时各物质物质的量/mol | 达平衡过程体系 能量的变化 | ||||
| CO | H2O | CO2 | H2 | |||
| ① | 1 | 4 | 0 | 0 | 放出热量:32.8kJ | |
| A. | 容器①中反应达平衡时,CO的转化率为80% | |
| B. | 平衡时,两容器中CO2的浓度相等 | |
| C. | 容器①中CO的转化率等于容器②中CO2的转化率 | |
| D. | 容器①中CO反应速率等于H2O(g)的反应速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
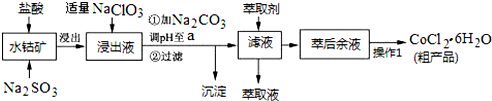
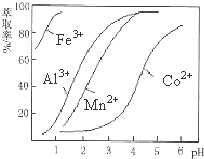
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
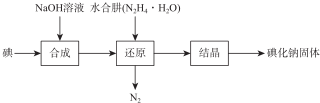
| 测定 序号 | 待测液体积/mL | 标准液滴定管起点读数/mL | 标准液滴定管终点读数/mL |
| 1 | 25.00 | 0.06 | 24.04 |
| 2 | 25.00 | 0.02 | 24.02 |
| 3 | 25.00 | 0.12 | 24.14 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com