
在一密闭恒容的容器中进行下列反应:4NH3(g)+5O2(g) 4NO(g)+6H2O(g),在一定条件下达到平衡,现向反应容器中通入少量的氯化氢气体,产生的结果是 ()。
4NO(g)+6H2O(g),在一定条件下达到平衡,现向反应容器中通入少量的氯化氢气体,产生的结果是 ()。
A.容器内的压强增大
B.原平衡不受影响
C.正反应速率减小
D.NO的浓度不变
科目:高中化学 来源: 题型:阅读理解
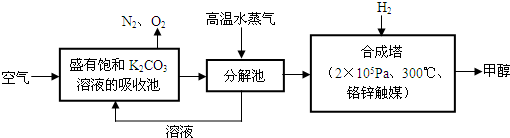
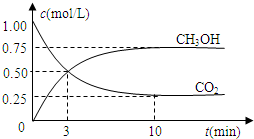
查看答案和解析>>
科目:高中化学 来源:2012-2013学年浙江省杭州市西湖高级中学高二5月月考化学试卷(带解析) 题型:单选题
可逆反应:2A(气) + 3B(气)  3C(气),一定条件下,在一密闭、恒容的容器中,使一定量A和B气体反应,下列叙述能用来判断达到平衡状态的是:
3C(气),一定条件下,在一密闭、恒容的容器中,使一定量A和B气体反应,下列叙述能用来判断达到平衡状态的是:
A.各物质的浓度之比为c(A):c(B):c(C) = 2:3:3
B.气体的总体积是反应开始时的 3/5
C.混合气体的密度不变
D.单位时间内, 若消耗了 a mol A 物质, 同时也消耗了 1.5 a mol 的C物质
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)以下反应(或过程):①硝酸铵晶体溶于水 ②燃烧天然气 ③生石灰与水反应
④稀盐酸与氢氧化钠溶液反应 ⑤Ba(OH)2·8H2O与氯化铵晶体反应 ⑥锌粒和稀硫酸混合,
其中属于放热反应(或过程)的是 (填序号),写出吸热反应的化学方程式
 。
。
(2)以反应2Fe3+ + Cu=2Fe2++ Cu2+为原理设计一个原电池,
在方框中画出原电池的示意图(在图上标出两极材料、
正负极、电解质溶液和电子流向)。
(3)用氮化硅(Si3N4)陶瓷代替金属制造发动机的耐热部件,
能大幅度提高发动机的热效率。工业上用化学气相沉积法制备氮化硅,其反应如下:
3SiCl4(g)+2N2(g)+6H2(g)![]() Si3N4 (s)+12HCl(g),一定条件下,在密闭恒容的容器中,表示
Si3N4 (s)+12HCl(g),一定条件下,在密闭恒容的容器中,表示
上述反应达到化学平衡状态的是 。
①3υ逆(N2)=υ正(H2) ②υ逆(HCl)=4υ正(SiCl4) ③混合气体的密度保持不变
④c(N2): c(H2): c(HCl)=1:3:6
 ①哪一时间段(指0~1、1~2、2~3、3~4、4~5min)反应速率最大 ,原因是该反应是 。
①哪一时间段(指0~1、1~2、2~3、3~4、4~5min)反应速率最大 ,原因是该反应是 。
②哪一时段的反应速率最小 ,原因是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com