
可逆反应mA(固)+nB(气) e C(气)+f D(气),反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如下图:下列叙述正确的是
e C(气)+f D(气),反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如下图:下列叙述正确的是
A.达平衡后,加入催化剂则C%增大
B.达平衡后,增加A的量有利于平衡向右移动
C.化学方程式中n>e+f
D.达平衡后,若升温,平衡左移
 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案科目:高中化学 来源: 题型:
已知反应:X + Y = M + N为放热反应,对该反应的下列说法正确的是
A. X能量一定高于M
B. X和Y的总能量一定高于M和N的总能量
C. Y能量一定高于N
D.因该反应为放热反应,故不必加热就可发生
查看答案和解析>>
科目:高中化学 来源: 题型:
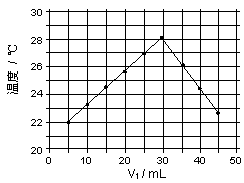
将V1mL1.0mol/LNaOH溶液和V2mL未知浓度的HCl溶液混合均匀后测量并记录溶液温度,实验结果如右图所示(实验中始终保持V1+V2=50mL)。下列叙述不正确的是
A 做该实验时环境温度低于22℃
B 该实验表明化学能和热能可以相互转化
C HCl溶液的浓度大于1.0mol/L
D 该实验表明当V1=30mL恰好中和
查看答案和解析>>
科目:高中化学 来源: 题型:
0.5molCH4完全燃烧生成CO2和液态H2O时,放出445kJ热量,则CH4燃烧热的热化学方程式是
A.2CH4( g)+4O2(g)=2CO2(g)+4H2O(1) △H = +890kJ·mol-1
B.CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H = +890 kJ·mol-1
C.1/2CH4(g)+O2(g)=1/2CO2(g)+H2O(g) △H = —445 kJ·mol-1
D. CH4(g)+2O2(g)=CO2(g)+2H2O(1) △H = —890 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定条件下,把一定量NH3充入容积固定的密闭容器中,发生反应2NH3 (g) 3H2(g)+N2(g)。达到平衡时,若保持温度不变,增加N2的浓度。下列说法正确的是
3H2(g)+N2(g)。达到平衡时,若保持温度不变,增加N2的浓度。下列说法正确的是
A.平衡向正反应方向移动 B.化学平衡常数不变
C.化学平衡常数增大 D.化学平衡常数减小
查看答案和解析>>
科目:高中化学 来源: 题型:
向某一容积为5 L的密闭容器中,加入 0.2 mol CO和0.2 mol H2O,在800℃和催化剂的条件下,发生如下反应:CO(g)+H2O(g)  CO2(g)+H2(g) ΔH>0,反应中CO2的浓度随时间变化关系如下图所示:
CO2(g)+H2(g) ΔH>0,反应中CO2的浓度随时间变化关系如下图所示:
(1)由图可知,反应从开始至达到平衡时,CO的化学反应速率v(CO)= ;H2的物质的量浓度c(H2)= ;该温度下此反应的平衡常数K= 。
(2)能说明该反应已达到平衡状态的是 (填序号)。
①CO、H2O、CO2、H2的浓度都相等
②密闭容器内压强保持不变
③CO减少的化学反应速率和CO2减少的化学反应速率相等
④CO、H2O、CO2、H2的浓度都不再发生变化
⑤密闭容器内密度保持不变
(3)若开始时向该容器中加入CO、H2O(g)、CO2和H2各0.1 mol,在相同条件下,反应达到平衡时,水蒸气的物质的量浓度c(H2O)= 。
(4)查表已知BaSO4(s)+4C(s) 4CO(g)+BaS(s) △H1= +571.2 kJ·mol-1 ①
4CO(g)+BaS(s) △H1= +571.2 kJ·mol-1 ①
BaSO4(s)+2C(s)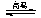 2CO2(g)+BaS(s) △H2= +226.2 kJ·mol-1 ②
2CO2(g)+BaS(s) △H2= +226.2 kJ·mol-1 ②
则反应C(s)+CO2(g)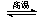 2CO(g)的△H= 。
2CO(g)的△H= 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列物质的转化在给定条件下不能实现的是( )
A.Ca(ClO)2(aq)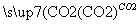 HClO(aq)
HClO(aq)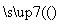 HCl(aq)
HCl(aq)
B.H2SiO3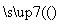 SiO2
SiO2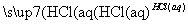 SiCl4
SiCl4
C.Al2O3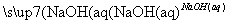 NaAlO2(aq)
NaAlO2(aq)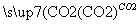 Al(OH)3
Al(OH)3
D.Fe2O3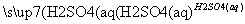 Fe2(SO4)3(aq)
Fe2(SO4)3(aq)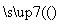 无水Fe2(SO4)3
无水Fe2(SO4)3
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,向20 mL 0.2 mol·L-1 H2A溶液中滴加0.2 mol·L-1 NaOH溶液。有关微粒物质的量变化如下图(其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-)。根据图示判断,下列说法正确的是( )
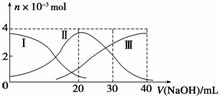
A.H2A在水中的电离方程式是:H2A===H++HA-、HA-H++A2-
B.当V(NaOH)=20 mL时,溶液中各粒子浓度的大小顺序为c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-)
C.等体积等浓度的NaOH溶液与H2A溶液混合后,其溶液中水的电离程度比纯水大
D.当V(NaOH)=30 mL时,溶液中存在以下关系:2c(H+)+c(HA-)+2c(H2A)=c(A2-)+2c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
海水开发利用的部分过程如图所示。下列说法错误的是
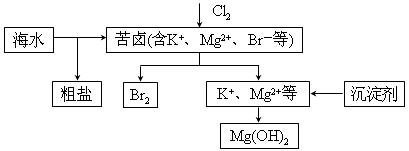
A.向苦卤中通入Cl2是为了提取溴
B.粗盐可采用除杂和重结晶等过程提纯
C.工业生产常选用NaOH作为沉淀剂
D.富集溴一般先用空气和水蒸气吹出单质溴,再用SO2将其还原吸收
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com