
纯碱中常含有少量NaCl杂质,某实验小组用下图装置测定n g纯碱样品中Na2CO3的质量分数。
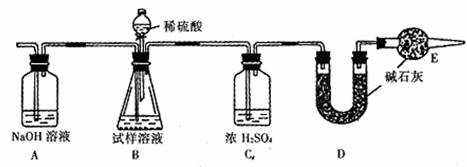
(1)测定实验的步骤为______________________。(填序号)
①称量盛有碱石灰的干燥管D的质量为m1 g;
②称量n g纯碱样品,将其放入锥形瓶内;
③按装置图组装仪器,并检查气密性;
④再次称量干燥管D的总质量为m2 g;
⑤从分液漏斗注入一定量的稀硫酸,直到B中不再产生气体为止。再缓缓鼓入空气一段时间。
(2)在用托盘天平称量样品时,如果天平的指针向右偏转,说明______________________
_________________________________________________________。
(3)装置E的作用是__________________________________,步骤⑤中“缓缓鼓入空气一段时间”的原因是_______________________________________________。
(4)A中NaOH溶液的作用________________________________。
(5)该试样中纯碱的质量分数的计算式为_________________________________。
科目:高中化学 来源:2011年高考化学总复习30分钟限时训练:专题12 化学与自然资源的开发利用 题型:058
海洋中含有丰富的资源,是人类的巨大宝库.我国拥有很长的海岸线,东部沿岸海滩平缓,多细沙,日照时间长,不少盐场均集中于此.回答下列问题:
(1)制海盐方法如下:海水涨潮时,将海水引入盐田,等落潮时,再用日晒的方法,待盐田水分蒸发到一定程度时,再撒入食盐颗粒(称为晶种),食盐晶体即从饱和溶液中析出.请说明盐田获得食盐晶体的条件________.
(2)以食盐为主要原料可以制备纯碱.试用化学方程式表示其制备过程:
________.
此法制得的纯碱中常含有少量氯化钠,要测定样品中的纯碱的质量分数,还可采用下图中的装置进行实验:
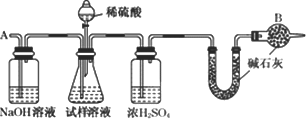
请你用一句话叙述该实验设计的基本原理:________.
(3)氯碱化工厂制得的烧碱中也含有少量氯化钠(假设不含其他杂质),用中和滴定法设计一个实验方案以测定样品中烧碱和氯化钠的质量分数.试剂是0.100 0 mol/L盐酸、酚酞溶液,仪器是50 mL的酸式滴定管、锥形瓶.其实验的主要步骤是________、________、滴定.
(4)工业上用电解法制备金属钠,但制备金属钾一般不采用电解熔融氯化钾,而是采用热还原法来制备.在850℃用金属钠来还原KCl反应如下:
Na(液)+KCl(液)![]() NaCl(液)+K(气).
NaCl(液)+K(气).
工业上应采用哪些措施才能使反应向正反应方向移动?
________.
查看答案和解析>>
科目:高中化学 来源: 题型:
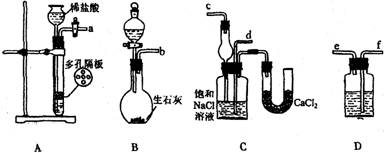
(14分)我国化工专家侯德榜的“侯氏制碱法”曾为世界制碱工业做出了突出贡献。他利用NaHCO3、NaCl、NH4Cl等物质溶解度的差异,以食盐、氨气、二氧化碳等为原料先制得NaHCO3,进而生产出纯碱。下面是在实验室中模拟“侯氏制碱法”制取NaHCO3的实验步骤:
第一步:连接好装置,检验气密性,在仪器内装入药品。
第二步:先让一装置发生反应,直到产生的气体不能再在C中溶解时,再通入另一装置中产生的气体,片刻后,C中出现固体。继续向C中通入两种气体,直到不再有固体产生。
第三步:过滤C中所得的混合物,得到NaHCO3固体。
第四步:向滤液中加入适量的NaCl粉末,有NH4Cl晶体析出。……
请回答下列问题:
(1)装置的连接顺序是:(a)接( ) ( )接( );(b)接( )
(2)A中常选用的固体反应物为____________;D中应选用的液体为___________ (填化学式)
(3)第二步骤中必须先让________装置先发生反应。
(4)C中用球形干燥管而不用直导管,其作用是____________________________,C中广口瓶内产生固体的总化学方程式为 。
(5)在第四步中分离NH4Cl晶体的操作是________________(填操作名称);其所得的NH4Cl晶体中常含有少量的NaCl和NaHCO3约占5%—8%),请设计一个简单的实验证明所得固体的成分中含有Na+。简要写出操作和现象 。
查看答案和解析>>
科目:高中化学 来源:2012届四川省资中县高三零模考试理综试题(化学部分) 题型:实验题
(14分)我国化工专家侯德榜的“侯氏制碱法”曾为世界制碱工业做出了突出贡献。他利用NaHCO3、NaCl、NH4Cl等物质溶解度的差异,以食盐、氨气、二氧化碳等为原料先制得NaHCO3,进而生产出纯碱。下面是在实验室中模拟“侯氏制碱法”制取NaHCO3的实验步骤:
第一步:连接好装置,检验气密性,在仪器内装入药品。
第二步:先让一装置发生反应,直到产生的气体不能再在C中溶解时,再通入另一装置中产生的气体,片刻后,C中出现固体。继续向C中通入两种气体,直到不再有固体产生。
第三步:过滤C中所得的混合物,得到NaHCO3固体。
第四步:向滤液中加入适量的NaCl粉末,有NH4Cl晶体析出。……
请回答下列问题:
(1)装置的连接顺序是:(a)接( ) ( )接( );(b)接( )
(2)A中常选用的固体反应物为____________;D中应选用的液体为___________ (填化学式)
(3)第二步骤中必须先让________装置先发生反应。
(4)C中用球形干燥管而不用直导管,其作用是____________________________,C中广口瓶内产生固体的总化学方程式为 。
(5)在第四步中分离NH4Cl晶体的操作是________________(填操作名称);其所得的NH4Cl晶体中常含有少量的NaCl和NaHCO3约占5%—8%),请设计一个简单的实验证明所得固体的成分中含有Na+。简要写出操作和现象 。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年四川省县高三零模考试理综试题(化学部分) 题型:实验题
(14分)我国化工专家侯德榜的“侯氏制碱法”曾为世界制碱工业做出了突出贡献。他利用NaHCO3、NaCl、NH4Cl等物质溶解度的差异,以食盐、氨气、二氧化碳等为原料先制得NaHCO3,进而生产出纯碱。下面是在实验室中模拟“侯氏制碱法”制取NaHCO3的实验步骤:
第一步:连接好装置,检验气密性,在仪器内装入药品。
第二步:先让一装置发生反应,直到产生的气体不能再在C中溶解时,再通入另一装置中产生的气体,片刻后,C中出现固体。继续向C中通入两种气体,直到不再有固体产生。
第三步:过滤C中所得的混合物,得到NaHCO3固体。
第四步:向滤液中加入适量的NaCl粉末,有NH4Cl晶体析出。……
请回答下列问题:
(1)装置的连接顺序是:(a)接( ) ( )接( );(b)接( )
(2)A中常选用的固体反应物为____________;D中应选用的液体为___________ (填化学式)
(3)第二步骤中必须先让________装置先发生反应。
(4)C中用球形干燥管而不用直导管,其作用是____________________________,C中广口瓶内产生固体的总化学方程式为 。
(5)在第四步中分离NH4Cl晶体的操作是________________(填操作名称);其所得的NH4Cl晶体中常含有少量的NaCl和NaHCO3约占5%—8%),请设计一个简单的实验证明所得固体的成分中含有Na+。简要写出操作和现象 。
查看答案和解析>>
科目:高中化学 来源:模拟题 题型:填空题

 NaCl(l)+ K(g)。工业上应采用哪些措施才能使反应向正反应方向移动?___________________
NaCl(l)+ K(g)。工业上应采用哪些措施才能使反应向正反应方向移动?___________________ 查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com