
铝箔在空气中加热,金属熔化而不滴落的原因是( )
A.熔化的金属铝非常黏稠
B.铝的密度小,所受重力也小
C.大部分铝已经被氧化
D.氧化膜的熔点比铝高,兜住了熔化的铝
科目:高中化学 来源: 题型:
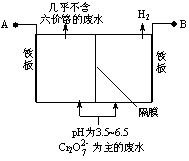
电解法处理含铬(六价铬)废水的原理如图所示,阳极区溶液中的离子反应是Cr2O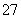 +6Fe2++14H+ == 2Cr3+ +6Fe3+ 7H2O。下列说法正确的是
+6Fe2++14H+ == 2Cr3+ +6Fe3+ 7H2O。下列说法正确的是
A.电解槽中H+向阳极移动
B.阳极的电极反应式是:Fe-3e-= Fe3+
C.电解一段时间后,阴极区溶液的pH升高
D.阳极的铁板可用石墨代替
查看答案和解析>>
科目:高中化学 来源: 题型:
2013年雾霾天气多次肆虐我国中东部地区。其中,汽车尾气和燃煤尾气是造成空气污染的原因之一。
(1)CO2是大气中含量最高的一种温室气体,控制和治理CO2是解决温室效应的有效途径。目前,由CO2来合成二甲醚已取得了较大的进展,其化学反应是:
2CO2(g)+6H2(g)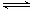 CH3OCH3(g)+3H2O(g) △H>0。
CH3OCH3(g)+3H2O(g) △H>0。
①写出该反应的平衡常数表达式 。
②判断该反应在一定条件下,体积恒定的密闭容器中是否达到化学平衡状态的依据是 。
A.容器中密度不变
B.单位时间内消耗2molCO2,同时消耗1mol二甲醚
C.v(CO2)︰v(H2)=1︰3
D.容器内压强保持不变
(2)汽车尾气净化的主要原理为:2NO(g)+2CO (g) 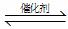 2CO2 (g) +N2 (g) 。在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线,如图所示。据此判断:
2CO2 (g) +N2 (g) 。在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线,如图所示。据此判断:
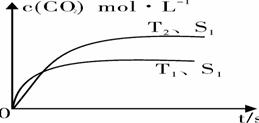
① 该反应的ΔH 0(选填“>”、“<”)。
②当固体催化剂的质量一定时,增大其表面积可提高化学反应速率。若催化剂的表面积S1>S2,在右图中画出c(CO2)在T2、S2条件下达到平衡过程中的变化曲线。
(3)已知:CO(g)+ 2H2(g)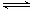 CH3OH(g)△H = -a kJ•mol-1。
CH3OH(g)△H = -a kJ•mol-1。
①经测定不同温度下该反应的平衡常数如下:
| 温度(℃) | 250 | 300 | 350 |
| K | 2.041 | 0.270 | 0.012 |
若某时刻、250℃测得该反应的反应物与生成物的浓度为c(CO)=0.4 mol·L-1、c(H2)=0.4 mol·L-1、c(CH3OH)=0.8 mol·L-1, 则此时v正 v逆(填“>”、“<”或“=”)。
②某温度下,在体积固定的2L的密闭容器中将1 mol CO和2 mol H2混合,测得不同时刻的反应前后压强关系如下:
| 时间(min) | 5 | 10 | 15 | 20 | 25 | 30 |
| 压强比(P后/P前) | 0.98 | 0.90 | 0.80 | 0.70 | 0.70 | 0.70 |
达到平衡时CO的转化率为 。
(4)氨有着广泛的用途,如可用于化肥、硝酸、合成纤维等工业生产。用0.10mol·L—1盐酸分别滴定20.00mL0.10mol·L—1的NaOH溶液和20.00mL0.10mol·L—1氨水所得的滴定曲线如下:
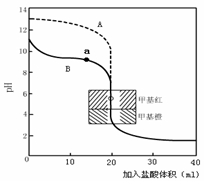
请指出盐酸滴定氨水的曲线为 (填A、B),请写出曲线a点所对应的溶液中各离子浓度由大到小的排列顺序 。
(5)液氨作为一种潜在的清洁汽车燃料已越来越被研究人员重视。它在安全性、价格等方面较化石燃料和氢燃料有着较大的优势。氨在燃烧实验验中相关的反应有:
4NH3(g)+3O2(g)= 2N2(g)+6H2O(l) △H1 ①
4NH3(g)+5O2(g)= 4NO(g)+6H2O(l) △H2 ②
4NH3(g)+6NO(g)= 5N2(g)+6H2O(l) △H3 ③
请写出上述三个反应中△H1、△H2、△H3三者之间关系的表达式,△H1= 。
(6)美国Simons等科学家发明了使NH3直接用于燃料电池的方法,其装置为用铂作为电极,加入电解质溶液中,其电池反应为 4NH3+3O2=2N2+6H2O。写出该燃料电池的负极反应式 。
(7)已知 :难溶电解质Cu(OH)2在常温下的Ksp=2×10-20,则常温下:
①某CuSO4溶液里c(Cu2+)=0.02 mol·L-1,如要生成Cu(OH)2沉淀,应调整溶液的pH,使之大于________。
②要使0.2 mol·L-1 CuSO4溶液中的Cu2+沉淀较为完全(使Cu2+浓度降至原来的千分之一),则应向溶液里加入NaOH溶液,使溶液的pH为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
在天平的左右两个托盘上放有两个烧杯,两个烧杯中分别盛有盐酸和氢氧化钠溶液,天平处于平衡状态,当分别向两烧杯中加入等质量的铝(酸和碱都是足量的)充分反应后( )
A.天平保持平衡 B.左高右低 C.左低右高 D.无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)实验室里常用浓盐酸与二氧化锰反应来制取少量的氯气,反应的化学方程式为:MnO2+4HCl(浓)  MnCl2+Cl2↑+2H2O,取一定量的浓盐酸使其与二氧化锰发生反应,产生的氯气在标准状况下的体积为22.4 L。
MnCl2+Cl2↑+2H2O,取一定量的浓盐酸使其与二氧化锰发生反应,产生的氯气在标准状况下的体积为22.4 L。
请回答下列问题:
①写出该反应的离子反应方程式_________________________,②反应中被氧化的HCl的物质的量为 ________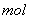 。③实验室备用的浓盐酸质量分数为36.5%,密度为1.19 g·cm-3,为使用方便,请计算出该浓盐酸的物质的量浓度_________
。③实验室备用的浓盐酸质量分数为36.5%,密度为1.19 g·cm-3,为使用方便,请计算出该浓盐酸的物质的量浓度_________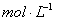 。
。
|
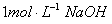 溶液,生成沉淀的质量和加入NaOH溶液的体积如下图所示。
溶液,生成沉淀的质量和加入NaOH溶液的体积如下图所示。 ①合金中镁的质量 g。
②盐酸的物质的量浓度 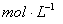 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
等质量的两块钠,第一块在足量氧气中加热,第二块在足量氧气(常温)中充分反应,则下列说法正确的是( )
A.第一块钠失去电子多
B.两块钠失去电子一样多
C.第二块钠的反应产物质量最大
D.两块钠的反应产物质量一样大
查看答案和解析>>
科目:高中化学 来源: 题型:
用坩埚钳夹住一小块刚用酸处理过的铝箔,在酒精灯上加热至熔化,发现熔化的铝并不滴落。下列关于上述实验现象的解释不正确的是( )。
A.铝箔在空气中不易燃烧 B.用酸处理时未能将氧化铝溶解
C.氧化铝的熔点比铝的熔点高 D.铝在空气中能很快形成氧化膜
查看答案和解析>>
科目:高中化学 来源: 题型:
下列现象或应用中,不能用胶体知识解释的是 ( )
A.在饱和FeCl3溶液中逐滴加入NaOH溶液,产生红褐色沉淀
B.实验时手指不慎划破,可从急救箱中取出FeCl3溶液止血
C.清晨,在茂密的树林,常常可以看到从枝叶间透过的一道道光柱
D.向豆浆中加入硫酸钙可制成可口的豆腐
查看答案和解析>>
科目:高中化学 来源: 题型:
用氯化钠固体配制1.00mol/L的NaCl溶液95mL,回答下列问题
⑴所需仪器为:托盘天平、量筒、50 mL烧杯、 mL容量瓶,若要完成实验,还需要两种玻璃仪器为: 、 。
⑵请写出该实验的实验步骤:
①计算,②称量 gNaCl, ③溶解,④移液,⑤ ,⑥ ,⑦ 摇匀。
⑶ 试分析下列操作,对所配溶液的浓度有何影响。(用偏低、偏高、无影响填空)。
①用天平称量氯化钠后,发现砝码底部有锈斑。所配溶液的浓度:
②为加速固体溶解,微热烧杯溶液并不断搅拌。在未降至20℃时,就将溶液转移至容量瓶定容。所配溶液的浓度:
③定容后,加盖、倒转、摇匀后,发现液面低于刻度线,又补加蒸馏水至刻度。则所配溶液的浓度:
④另一同学准确配制溶液后,从中取出25ml,其中NaCl的物质的量浓度为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com