
【题目】室温下,将1.000 mol/L盐酸滴入20.00 mL 1.000 mol/L氨水中,溶液pH和温度随加入盐酸体积变化曲线如图所示。下列有关说法正确的是

A. d点后,溶液温度略下降的主要原因是NH3·H2O电离吸热
B. a点由水电离出的c(H+)=1.0![]() mol/L
mol/L
C. b点:c(NH![]() )+c(NH3·H2O)=c(Cl-)
)+c(NH3·H2O)=c(Cl-)
D. c点:c(Cl-)=c(NH![]() )
)
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】如下图所示装置可用来制取和观察Fe(OH)2在空气中被氧化时颜色的变化.实验时必须使用铁屑和6mol·L1的硫酸,其他试剂任选.填写下列空白.
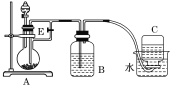
(1)B中盛一定量的NaOH溶液,A中应预先加入的试剂是________,A中反应的离子方程式是________________________________________。
(2)实验开始时就先将活塞E________(填“打开”或“关闭”),C中收集到气体的主要成分是________。
(3)简述生成Fe(OH)2的操作过程________________________________________。
(4)拔去装置B中的橡皮塞,使空气进入,装置B中发生的现象为 ______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(题文)化合物F(![]() )是重要的化工原料,其一种合成路线如下:
)是重要的化工原料,其一种合成路线如下:

已知

(1)写出B的官能团名称___________。
(2)下列有关物质C的说法正确的是________。
A.C的分子式是C9H12O3 B.C的核磁共振氢谱共有4组吸收峰
C.1mlC最多消耗1mol金属Na D.C可以发生取代、加成和消去反应
(3)写出①的化学方程式:____________________________________。
(4)E的结构简式为________________________________________________。
(5) 有多种同分异构体,能发生银镜反应的芳香族化合物有____________种,其中满足下列条件的同分异构体的结构简式为____________
有多种同分异构体,能发生银镜反应的芳香族化合物有____________种,其中满足下列条件的同分异构体的结构简式为____________
①1mol该物质最多消耗3 mol NaOH; ②苯环上一氯代物只有两种。
(6)参照上述合成路线,设计由乙烯合成2-丁醇的合成路线。(用合成路线流程图表示,并注明反应条件,合过程中只有无机试剂可任选) ____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氯化磷(PCl3)是一种用于有机合成的重要催化剂。已知:红磷与少量Cl2反应生成PCl3,与过量Cl2反应生成PCl5。PCl3遇O2会生成POCl3(三氯氧磷), POCl3溶于PCl3,PCl3遇水会强烈水解。PCl3、POCl3的熔沸点见下表。
物质 | 熔点/℃ | 沸点/℃ |
PCl3 | -112 | 75.5 |
POCl3 | 2 | 105.3 |
请答下面问题:
(1)选下图所示发生装置,可分别制备氯气

你选用的装置是___________,反应的离子方程式为____________
(2)实验室常用下图所示装置制取PCl3。

①玻璃管之间的连接需要用到胶皮管,连接的方法是:先把_______,然后稍稍用力即可把玻璃管插入橡皮管。
②B中所盛试剂是____________________,F中碱石灰的作用是_____________________。
③实验时,检查装置气密性后,向D装置的曲颈瓶中加入红磷,打开K3通入干燥的CO2,一段时间后,关闭K3,加热曲颈瓶至上部有黄色升华物出现时通入氯气,反应立即进行。通干燥CO2的作用是______________________________,C装置中的K1、 K2的设计也出于类似的目的,为了达到这—实验目的,实验时与K1、 K2有关的操作是___________________。
(3)实验制得的粗产品中常含有POCl3、PCl5等。加入红磷加热除去PCl5,加入红磷时发生反应的化学方程式为_________________________,然后通过__________________(填实验操作名称),即可得到较纯净的PCl3。
(4) 通过下面方法可测定产品中PCl3的质量分数:
①迅速称取1.00g产品,加水反应后配成250mL溶液:
②取以上溶液25.00mL,向其中加入10.00mL0.1000mol/L碘水(足量),充分反应;
③向②所得溶液中加入几滴淀粉溶液,用0.1000 mol/L的Na2S2O3溶液滴定;
④重复②、③操作,平均消耗0.1000 mol/L Na2S2O3溶液8.00mL.
己知:H3PO3+I2+H2O=H3PO4+2HI, I2+2Na2S2O3=2NaI+Na2S4O6,根据上述数据,假设测定过程中没有其他反应,该产品中PCl3的质量分数为_______ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知水中存在电离平衡:H2O![]() H++OH-。下列说法正确的是
H++OH-。下列说法正确的是
A. 升高温度,Kw增大,pH不变
B. 向水中加入氨水,平衡向逆反应方向移动,c(OH-)降低
C. 向水中通入CO2,c(H+)增大,平衡向逆反应方向移动,Kw不变
D. 向水中加入少量固体CH3COONa,平衡向逆反应方向移动,c(H+)降低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乳酸亚铁晶体{[CH3CH(OH)COO]2Fe·3H2O}(相对分子质量:288)可由乳酸与FeCO3反应制得,它易溶于水,是一种很好的补铁剂。
I.制备碳酸亚铁:装置如图所示。

(1)仪器B的名称是____________。
(2)实验操作如下:关闭活塞2,打开活塞1、3,加入适量稀硫酸反应一段时间,其目的是:_________,然后关闭活塞1,接下来的操作是:_________________。C中发生反应的离子方程式为_______________________________。
Ⅱ.制备乳酸亚铁:
向纯净的FeCO3固体加入足量乳酸溶液,在75℃下搅拌使之充分反应。
(3)该反应方程式为_______________________________________。为防止乳酸亚铁变质,在上述体系中还应加入______________________。反应结束后,将所得溶液隔绝空气低温蒸发、冷却结晶、过滤、洗涤、干燥得乳酸亚铁晶体。该晶体存放时应注意_______。
III.乳酸亚铁晶体纯度的测量:
(4)两位同学分别用不同方案进行测定:
①甲同学通过KMnO4滴定法测定样品中Fe2+的含量计算样品纯度,所得纯度总是大于100%,其原因可能是________________________________。
②乙同学经查阅文献后改用(NH4)4Ce(SO4)4滴定法测定样品中Fe2+的含量计算样品纯度(反应中Ce4+还原为Ce3+),称取6.00g样品配制成250.00mL溶液,取25.00mL用0.10mol·L-1(NH4)4Ce(SO4)4标准溶液滴定至终点,消耗标准液20.00mL。则产品中乳酸亚铁晶体的纯度为__________(以质量分数表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关图像说法不正确的是

A. 图①:向等浓度的碘化钠和氯化钠的混合溶液中加入硝酸银溶液
B. 图②:向pH和体积均相同的盐酸和醋酸两种溶液中分别加水稀释
C. 图③:向饱和Ca(OH)2溶液中通入CO2
D. 图④:向Ba(OH)2溶液中加入稀H2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人工模拟光合作用,设计的电化学实验装置如图所示,该装置能将H2O和CO2转化为O2和燃料(C3H8O)。下列说法正确的是

A. 该装置将化学能转化为光能和电能
B. 该装置工作时,H+从a极向b极迁移
C. 该转化过程中,水得到电子
D. 该装置中发生的总反应为6CO2+8H2O![]() 2C3H8O+9O2
2C3H8O+9O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室按照下图所示的操作程序用于提纯某种物质,下列分析一定正确的是

A. 该操作流程可用于分离水与四氯化碳
B. 操作I-定是过滤,目的是将固液分离
C. 可以用于从四氯化碳中提取碘单质
D. 可以提纯含少量BaSO4的NaCI固体混合物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com