
| A. | 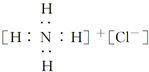 | B. |  | ||
| C. | 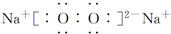 | D. |  |
分析 A.氯离子电子式书写错误;
B.铵根离子中氮原子与氢原子通过共价键结合;
C.过氧化钠中钠离子与过氧根离子通过离子键结合,氧原子间通过共价键结合;
D.阴离子电子式应用中括号括起来.
解答 解:A.氯化铵是离子化合物,由氨根离子与氯离子构成,电子式为: ,故A错误;
,故A错误;
B.溴化铵为离子化合物,阳离子为原子团,电子式中需要标出N、H原子的最外层电子数,溴化铵的电子式为: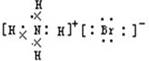 ,故A错误;
,故A错误;
C.过氧化钠的电子式为: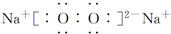 ,故C正确;
,故C正确;
D.氯化钙为离子化合物,氯化钙正确的电子式为: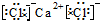 ,故D错误;
,故D错误;
故选:C.
点评 本题考查了常见化学用语的书写判断,明确物质的结构及所含化学键类型、电子式书写方法是解题关键,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| v正 | v逆 | 平衡常数K | 转化率α |
| [CO2]/mol•L-1 | [H2]/mol•L-1 | [CH4]/mol•L-1 | [H2O]/mol•L-1 | |
| 平衡Ⅰ | a | b | c | d |
| 平衡Ⅱ | m | n | x | y |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 3,5,5-三甲基辛烷
3,5,5-三甲基辛烷 3,4,4-三甲基-1-戊炔
3,4,4-三甲基-1-戊炔 1,3-二氯戊烷
1,3-二氯戊烷 1-甲基-4-乙基苯
1-甲基-4-乙基苯
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 二 | ① | ② | ||||||
| 三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 四 | ⑨ | ⑩ |
 ,非金属性最强的是F.
,非金属性最强的是F. ;含有化合价为+1价的⑦的具有漂白性的一种含氧酸
;含有化合价为+1价的⑦的具有漂白性的一种含氧酸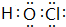 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
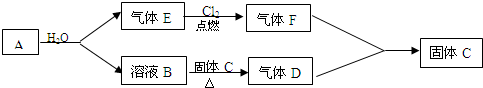

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 安全气囊中原料的配比为$\frac{n(Na{N}_{3})}{n(KN{O}_{3})}$=5 | |
| B. | 若在标准状况下,产生44.8L N2,则有0.25mol KNO3参与反应 | |
| C. | 上述复分解反应发生速度很快,瞬间能产生大量气体 | |
| D. | 根据安全气囊打开时产生气体的体积(标准状况),可大致计算出气囊中原料的质量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ,GSO3;
,GSO3;查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com