
(4分)取碳酸钠和碳酸氢钠的混合粉末样品22.1g,将其加热到质量不再改变,冷却后称固体质量为15.9g,将得到的15.9g固体配成600mL溶液。则:原样品中碳酸氢钠的物质的量为 mol ;所配溶液中Na+的物质的量浓度为 mol/L。
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:2014-2015学年湖北大冶一中等六校高三元月调考理综化学试卷(解析版) 题型:选择题
下列离子方程式书写正确的是
A.H218O中投入Na2O2固体:2H218O+2Na2O2===4OH-+4Na++18O2↑
B.Fe3O4与稀HNO3反应:Fe3O4+8H+===Fe2++2Fe3++4H2O
C.向NaHCO3溶液中加入少量Ca(OH)2:HCO3-+Ca2++OH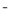 ===CaCO3↓+H2O
===CaCO3↓+H2O
D.将少量NaOH溶液加入到NH4HCO3溶液中:OH-+HCO3-===CO32-+H2O
查看答案和解析>>
科目:高中化学 来源:2014-2015学年安徽省淮南市高三一模理综化学试卷(解析版) 题型:填空题
(16分)Na、Cu、Fe、Cl、O、N是常见的6种元素。
(1)Fe位于元素周期表第_____周期第_____族;O的基态原子核外有______个未成对电子。
Cu的基态原子电子排布式为________。
(2)用“>”或“<”填空:
第一电离能 | 原子半径 | 稳定性 |
N_______O | Cl_______Na | NH3______H2O |
(3)液态N2H4与液态N2O4反应生成气态水,在25℃、101kPa下,已知该反应每消耗1mol N2H4放出519.85kJ的热量,该反应的热化学反应方程式是: 。
(4)古老的但仍是最有用的制备N2H4的方法是NaClO溶液氧化过量的NH3,写出该反应的离子方程式,并标出电子转移的方向和数目 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年安徽省合肥市高三第一次教学质量检测化学试卷(解析版) 题型:选择题
在Na2O2与CO2 的反应中,下列说法正确的是
A.该反应中Na2O2 是氧化剂,CO2 是还原剂
B.1mol Na2O2参加反应,有2mole—转移
C.Na2O2晶体中阴阳离子个数比为1:2
D.CO2分子中含有极性键和非极性键
查看答案和解析>>
科目:高中化学 来源:2014-2015学年安徽省合肥市高三第一次教学质量检测化学试卷(解析版) 题型:选择题
下列离子方程式表达正确的是
A.向氯化铁溶液中滴加HI溶液:2Fe3++2HI=2Fe2++2H++I2
B.向1mol/L 的AlCl3 溶液中加入过量的稀氨水:Al3++4NH3·H2O=AlO2―+4NH4++2H2O
C.向稀NH4HCO3 溶液中滴加过量NaOH溶液:NH4++OH―=NH3·H2O
D.向C6H5ONa溶液中通入适量CO2 :C6H5O― +CO2+H2O=C6H5OH+HCO3―
查看答案和解析>>
科目:高中化学 来源:2014-2015四川省攀枝花市高一上学期期末考试化学试卷(解析版) 题型:填空题
(6分)标出下列氧化还原反应的电子转移数目和方向,并写出氧化剂和还原剂
(1)2MnO2 + 4KOH + O2  2K2MnO4 + 2H2O
2K2MnO4 + 2H2O
氧化剂是 ,还原剂是
(2)3NaClO3 +10HCl(浓) 3NaCl + 4Cl2↑+ 2ClO2↑ + 5H2O
3NaCl + 4Cl2↑+ 2ClO2↑ + 5H2O
氧化剂是 ,还原剂是
查看答案和解析>>
科目:高中化学 来源:2014-2015四川省攀枝花市高一上学期期末考试化学试卷(解析版) 题型:选择题
用NA表示阿伏加德罗常数。下列说法正确的是D
A.标准状况下,11.2L H2O所含分子数为0.5NA
B.1mol/L CaCl2溶液中所含Ca2+离子的数目为NA
C.标准状况下,足量的Fe与2.24 L Cl2反应转移电子的数目为0.3NA
D.通常状况下,由O2和O3组成的32g混合物中含氧原子的数目为2NA
查看答案和解析>>
科目:高中化学 来源:2014-2015江西省德镇市高一上学期期末化学试卷(解析版) 题型:填空题
(12分)海水是巨大的资源宝库,从海水中提取食盐和溴的过程如下:
已知:①海水中溴元素(以Br-表示)的浓度0.068g/L;
②Br2的沸点为59 ℃,微溶于水,有毒性和强腐蚀性。
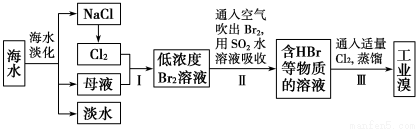
(1)请写出一种海水淡化的方法:_____________。
(2)海水中溴离子的物质的量浓度为_____________ 。
(3)步骤Ⅰ中已获得低溶度的含Br2溶液,步骤Ⅱ中又将Br2还原为Br-,步骤Ⅲ又得到Br2,其目的为________________。
(4)步骤Ⅱ用SO2水溶液吸收Br2,吸收率可达95%,有关反应的离子方程式为 。
(5)工业溴提纯可用蒸馏法,蒸馏时加热方法最好采用 ,蒸馏装置中仪器连接均不能用橡胶塞和橡胶管,其原因是_________________________________。
查看答案和解析>>
科目:高中化学 来源:2014-2015湖南省娄底市名校高一上学期期末化学试卷(解析版) 题型:计算题
(8分)已知标准状况下22.4LCO和CO2混合气体的质量为40g。将此混合气体通入1L1mol/LNaOH溶液充分反应,生成的盐用A、B表示。请将生成盐的化学式及质量填入下表(若只生成一种盐,此表不用填满)。
生成的盐 | 化学式 | 质量/g |
A | ||
B |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com