
| A. | 金属钠着火时使用泡沫灭火器灭火 | |
| B. | 用试管加热碳酸氢钠固体时使试管口竖直向上 | |
| C. | 浓硫酸溅到皮肤上时立即用稀氢氧化钠溶液冲洗 | |
| D. | 蒸馏时应先向冷凝管中通入冷凝水再加热 |
分析 A.金属钠着火生成过氧化钠,与泡沫灭火器喷出的二氧化碳反应;
B.碳酸氢钠分解生成水;
C.酸碱中和放出大量的热,且强酸、强碱具有强腐蚀性;
D.先接好冷凝水防止炸裂.
解答 解:A.金属钠着火生成过氧化钠,与泡沫灭火器喷出的二氧化碳反应,反应生成的氧气助燃,不能灭火,应利用沙土铺盖,故A错误;
B.碳酸氢钠分解生成水,则用试管加热碳酸氢钠固体时使试管口略向下倾斜,故B错误;
C.酸碱中和放出大量的热,且强酸、强碱具有强腐蚀性,则浓硫酸溅到皮肤上时立即用抹布擦拭,再水冲洗,最后涂上适量的碳酸氢钠溶液,故C错误;
D.加热时加入碎瓷片是为了防止溶液暴沸,先接好冷凝水防止炸裂,故D正确;
故选D.
点评 本题考查化学实验安全及事故处理,侧重化学与生活、实验安全的考查,把握物质的性质、实验基本技能、实验安全常识等为解答的关键,题目难度不大.


科目:高中化学 来源: 题型:选择题
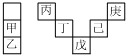 甲~庚等主族元素在周期表中的相对位置如下表,己的最高价氧化物对应的水化物有强脱水性,甲和丁在同一周期,甲原子最外层与最内层具有相同电子数.下列判断正确的是( )
甲~庚等主族元素在周期表中的相对位置如下表,己的最高价氧化物对应的水化物有强脱水性,甲和丁在同一周期,甲原子最外层与最内层具有相同电子数.下列判断正确的是( )| A. | 气态氢化物的稳定性:庚<己<戊 | |
| B. | 庚与戊的原子序数相差24 | |
| C. | 庚与甲形成的单核离子半径大小为:庚<甲 | |
| D. | 丁的最高价氧化物可用于制造计算机的芯片 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.8g重水(D2O)中含有的质子数和电子数均为NA | |
| B. | 常温下,O2和O3的混合气体共16g中含有的氧原子数为NA | |
| C. | 标准状况下,22.4L NO和22.4L O2混合后所得气体中分子总数为1.5NA | |
| D. | 将11.2LCl2通入足量的石灰乳中制备漂白粉,转移的电子数为0.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含等物质的量的Al3+、NH4+的溶液中,逐滴加入NaOH溶液:Al3+、NH4+ | |
| B. | 含等物质的量的FeBr2、FeI2的溶液中,缓慢通入氯气:I-、Br-、Fe2+ | |
| C. | 含等物质的量的Fe3+、Cu2+的溶液中,加入铁粉:Cu2+、Fe3+ | |
| D. | 含等物质的量的CH3COO-、ClO-溶液中,逐滴加入稀盐酸:CH3COO-、ClO- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
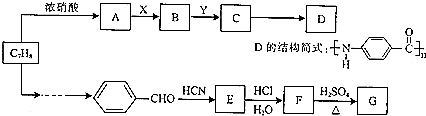
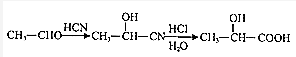
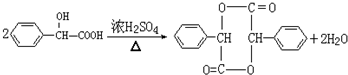 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 目前使用的元素周期表中,最长的周期含有36种元素 | |
| B. | 只有在原子中,质子数才与核外电子数相等 | |
| C. | 金属元素与非金属元素能形成共价化合物 | |
| D. | 非金属元素形成的共价化合物中,原子的最外层电子数只能是2或8 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
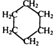 可用键线式表示为
可用键线式表示为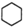 ,
,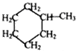 可用键线式表示为
可用键线式表示为 ;
;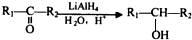 ;
;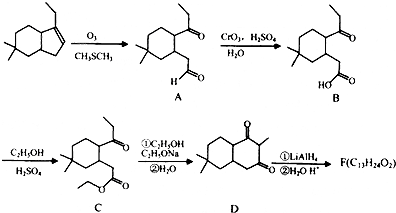
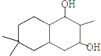 ;
;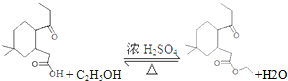 ;
;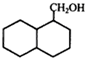 结构
结构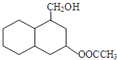 .
.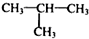 制
制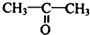 的流程图并注明反应条件.
的流程图并注明反应条件.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 弱酸 | HCOOH | HCN | H2CO3 |
| 电离平衡常数 ( 25℃) | Ki=1.77×10-4 | Ki=5.0×10-10 | Ki1=4.3×10-7 Ki2=5.6×10-11 |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com