
分析 A、B、D、E、Z、G、M七种元素位于元素周期表前四周期,原子序数依次增大,元素周期表中原子半径最小的是A,则A为H元素;化合物DE2为红棕色气体,DE2为NO2为,则D为N、E为O元素;B原子最外层有两个未成对电子,B的原子序数小于N,则B为C元素;Z的单质易与水反应且只作氧化剂,则Z为F元素;G是前四周期中第一电离能最小的元素,则G为K元素;M是第四周期元素,最外层只有一个电子,其余各层电子均充满,核外电子数为2+8+18+1=29,则E为Cu,据此进行解答(1)~(4);
(5)元素X位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2,核外电子数为2+8+18+2=30,则X为Zn;元素Y基态原子的3p轨道上有4个电子,则Y为S元素,据此进行解答.
解答 解:A、B、D、E、Z、G、M七种元素位于元素周期表前四周期,原子序数依次增大,元素周期表中原子半径最小的是A,则A为H元素;化合物DE2为红棕色气体,DE2为NO2为,则D为N、E为O元素;B原子最外层有两个未成对电子,B的原子序数小于N,则B为C元素;Z的单质易与水反应且只作氧化剂,则Z为F元素;G是前四周期中第一电离能最小的元素,则G为K元素;M是第四周期元素,最外层只有一个电子,其余各层电子均充满,核外电子数为2+8+18+1=29,则E为Cu,
(1)B、D、E分别为C、N、O元素,同一周期元素,元素的第一电离能随着原子序数增大而增大,但第IIA族、第VA族元素第一电离能大于其相邻元素,C、N、O元素处于同一周期且原子序数逐渐增大,N处于第VA族,所以第一电离能大小为:N>O>C,
故答案为:N>O>C;
(2)G为K元素,原子序数为19,其原子的价电子排布式是4s1;M为Cu元素,原子序数为29,其核外电子排布式为[Ar]3d104s1,位于周期表中第四周期第ⅠB 族,
故答案为:4s1;第四周期第ⅠB族;
(3)NF3中N价电子结构为2s22p3,价电子对数为:$\frac{5+3}{2}$=4,形成了四条杂化轨道,即N的杂化类型为sp3,三个电子分别与F成键,形成3个共用电子对,还有一对孤对电子,因而为三角锥形,属于极性分子,
故答案为:三角锥形;极性;sp3;
(4)D的最高价氧化物对应的水化物甲为硝酸,硝酸与气体DA3化合生成离子化合物乙为硝酸铵,硝酸电离出的氢离子抑制了水的电离,硝酸铵中铵根离子水解促进了水的电离,则常温下,硝酸溶液中水电离的氢离子等于溶液中氢氧根的浓度为:$\frac{1{0}^{-14}}{1{0}^{-5}}$mol/L=10-9mol/L,硝酸铵溶液中氢离子为水电离产生,浓度为10-5mol/L,故由水电离出的$\frac{c({H}^{+})_{甲}}{c({H}^{+})_{乙}}$=$\frac{1{0}^{-9}mol/L}{1{0}^{-5}mol/L}$=10-4;
硝酸铵溶液中,铵根离子水解,溶液呈酸性,故溶液中所含离子的物质的量浓度由大到小的顺序是c(NO3-)>c(NH4+)>c(H+)>c(OH-),
故答案为:10-4;c(NO3-)>c(NH4+)>c(H+)>c(OH-);
(5)元素X位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2,核外电子数为2+8+18+2=30,则X为Zn;元素Y基态原子的3p轨道上有4个电子,则Y为S元素,
①X与Y所形成化合物中X的化合价等于其族序数,Zn位于ⅡB族,则其化合价为+2价;Y达到8电子的稳定结构时的化合价为-2价,则二者形成的化合物为ZnS,
故答案为:ZnS;
②水分子与乙醇分子之间形成氢键,H2O在乙醇中的溶解度大于H2S,
故答案为:水分子与乙醇分子间形成氢键而不与H2S分子形成氢键;
③X的氯化物与氨水反应可形成配合物[Zn(NH3)4]Cl2,1mol该配合物中含有12molN-H、4mol配位键,故含有σ 键的数目为16NA,
故答案为:16NA.
点评 本题考查了原子结构与元素周期律的关系,题目难度较大,推断元素为解答关键,注意熟练掌握原子结构与元素周期律、元素周期表的关系,试题培养了学生的分析能力及逻辑推理能力.


 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案科目:高中化学 来源: 题型:实验题
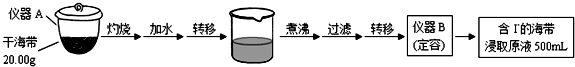
| V(AgNO3)/mL | 15.00 | 19.00 | 19.80 | 19.98 | 20.00 | 20.02 | 21.00 | 23.00 | 25.00 |
| E/mV | -225 | -200 | -150 | -100 | 50.0 | 175 | 275 | 300 | 325 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硝酸银溶液与盐酸反应生成氯化银 | |
| B. | 镁条与氯化铵溶液反应生成氢气 | |
| C. | 盐酸与碳酸钙反生成二氧化碳 | |
| D. | 硫酸铝溶液和小苏打溶液反应生成二氧化碳 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铬元素在周期表中处于第四周期V IB族 | |
| B. | 铬原子的外围电子层排布为3d44s2 | |
| C. | 铬原子中,质子数为24 | |
| D. | 铬元素位于元素周期表的d区,是过渡元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 盐酸是一种非常重要的化工原料,在工业上和实验室中有着广泛的应用.
盐酸是一种非常重要的化工原料,在工业上和实验室中有着广泛的应用.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3CH(CH3)CH(C2H5)CH3的系统命名法的名称为2-甲基-3-乙基丁烷 | |
| B. | 乙炔的结构简式为CHCH,乙烯的球棍模型为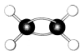 | |
| C. | 己烯和苯都是不饱和烃,都能使酸性高锰酸钾溶液褪色 | |
| D. | 向溴乙烷中直接滴加硝酸银溶液,看不到淡黄色沉淀 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com