
【题目】下列关于物质或离子检验的叙述正确的是
A. 在溶液中加酸化的BaCl2溶液,出现白色沉淀,证明原溶液中有SO![]()
B. 用铂丝蘸取少量某溶液进行焰色反应,火焰呈黄色,证明该溶液一定是钠盐溶液
C. 气体通过无水CuSO4,粉末变蓝,证明原气体中含有水蒸气
D. 将气体通入澄清石灰水,溶液变浑浊,证明原气体是SO2
科目:高中化学 来源: 题型:
【题目】下列物质按照单质,氧化物,混合物分类正确的是( )
A. 氧气、 水、 硫酸 B. 氢气、二氧化碳、盐酸
C. 空气,水, 稀硫酸 D. 空气,二氧化碳,稀盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应A(g) + 3B(g) 2C(g) + 2D(g) 在四种不同情况下的反应速率分别为:① ![]() 、 ②
、 ② ![]() 、 ③
、 ③ ![]() 、④
、④ ![]() ,该反应进行的快慢顺序为
,该反应进行的快慢顺序为
A. ①>③=②>④ B. ①>②=③>④ C. ②>①=④>③ D. ①>④>②=③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用元素的化合价推测物质的性质是化学研究的重要手段.如图是硫元素的常见化合价与部分物质类别的对应关系:

(1)从硫元素化合价变化的角度分析,图中既有氧化性又有还原性的化合物有_______(填化学式).
(2)将X与Y混合,可生成淡黄色固体.该反应中氧化剂与还原剂的物质的量之比为_______.
(3)检验物质Y的方法是_______________________________.
(4)Z的浓溶液与铜单质在一定条件下可以发生化学反应,该反应的化学方程式为_______.
(5)Na2S2O3是重要的化工原料.从氧化还原反应的角度分析,下列制备Na2S2O3的方案理论上可行的是______(填代号).
a.Na2S+S b.Na2SO3+S c.SO2+Na2SO4 d.Na2SO3+Na2SO4
(6)已知Na2SO3能被K2Cr207氧化为Na2SO4则24mL 0.05molL﹣1的Na2SO3溶液与 20mL 0.02molL﹣1的溶液恰好反应时,Cr元素在还原产物中的化合价为________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新制氯水与久置的氯水相比较,下列结论不正确的是
A. 颜色相同 B. 前者能使有色布条褪色
C. 都含有H+ D. 加AgNO3溶液都能生成白色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是
A. 足量的KI溶液与FeCl3溶液反应后,用CCl4萃取其中的I2,分液,在水溶液中滴加KSCN溶液仍呈血红色,说明该反应有一定的限度
B. 在一定条件下,一份双氧水样品经过2 h,H2O2的浓度从0.05 mol·L-1下降到0.03 mol·L-1,H2O2在这2 h中分解的平均反应速率约为0.015 mol·L-1·h-1
C. 其他条件相同时,反应温度升高,对于吸热反应,反应速率加快,对于放热反应,反应速率减慢
D. 一定条件下,固定体积的容器中发生反应A(g)+B(g) ![]() 2C(g),当容器内A、B、C的浓度之比为1∶1∶2时,该反应处于平衡状态
2C(g),当容器内A、B、C的浓度之比为1∶1∶2时,该反应处于平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】pH=a的某电解质溶液中,插入两支惰性电极,通直流电一段时间后,溶液的pH>a,则该电解质可能是
A. Na2SO4 B. H2SO4 C. AgNO3 D. NaCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢气是一种理想的绿色能源。利用生物质发酵得到的乙醇制取氢气,具有良好的应用前景。乙醇水蒸气重整制氢的部分反应过程如下图所示:
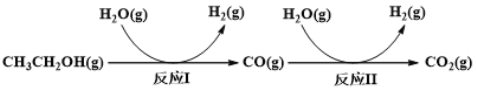
已知:反应I和反应II的平衡常数随温度变化曲线如下图所示。
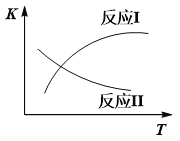
(1)①试说明反应Ⅰ能否发生自发反应______________________________________。
②反应Ⅰ、Ⅱ达平衡后,若在恒温恒压条件下,向体系中充入N2,CO的体积分数会________________(填“上升”、“不变”、“下降”)。
(2)反应II,在进气比[n(CO) : n(H2O)]不同时,测得相应的CO的平衡转化率见下图1

(各点对应的反应温度可能相同,也可能不同)。
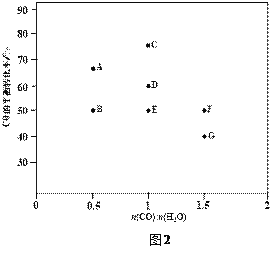
③图中D、E两点对应的反应温度分别为TD和TE。判断:TD______TE(填“<”“=”或“>”)。
④经分析计算,A、E和G三点对应的反应温度相同,理由是_________________________。
⑤在图2中,画出D点所对应温度下CO平衡转化率随进气比[n(CO) : n(H2O)]的曲线。____________
⑥以熔融Na2CO3为电解质的乙醇燃料电池具有广泛的应用,写出其负极的电极反应方程式。________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是实验室进行氨溶于水的“喷泉实验”的装置,下列叙述不正确的是( )

A. 该实验说明氨气极易溶于水
B. 进入烧瓶中的液体颜色由无色变为红色,说明氨水呈碱性
C. 氨水很稳定,将烧瓶内的红色溶液加热颜色不会发生变化
D. 形成“喷泉”的主要原因是氨气溶于水后,烧瓶内的气压小于大气压
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com