
| A. | 2Fe+4H2O═Fe2O3+4H2 | B. | 3NO2+H2O═2HNO3+NO | ||
| C. | Ca(OH)2+SO2═CaSO3+H2O | D. | Cu+2H2SO4(浓)═CuSO4+SO2↑+2H2O |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
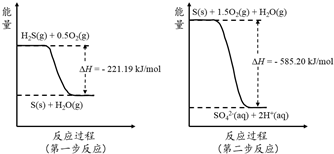
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
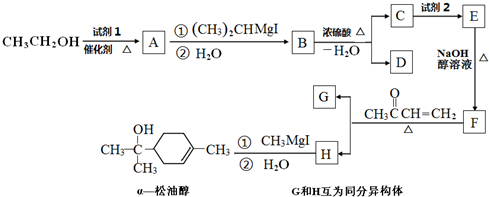
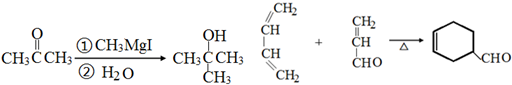
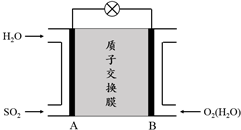
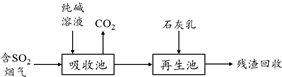
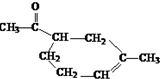 .
.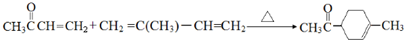 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
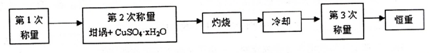

| 加热前质量 | 加热后质量 | ||
| m1 | m2 | m3 | m4 |
| 11.721g | 22.692g | 18.631g | a |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向AlCl3溶液中滴加氨水,会产生白色沉淀,再加入NaHSO4,沉淀不消失 | |
| B. | 浓的NaOH溶液不慎溅到皮肤上,可无用大量水冲洗,再涂上硼酸或稀醋酸溶液 | |
| C. | AlCl3溶液中加入过量NaF固体,再滴加氨水,无沉淀产生说明[AlF6]3-很难电离 | |
| D. | 检验Cl-时,为了排除SO42-的干扰,可先滴加过量的Ba(NO3)2溶液后,取上层溶液,再滴加AgNO3溶液,若有白色沉淀,则表明原溶液中有Cl-存在 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  的名称为2,3-二甲基戊烷 的名称为2,3-二甲基戊烷 | |
| B. | 18.0g的葡萄糖与乳酸[CH3CH(OH)COOH]混合物完全燃烧消耗氧气13.44L | |
| C. | 结构片段为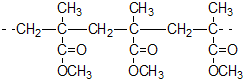 的高聚物,是通过加聚反应生成的 的高聚物,是通过加聚反应生成的 | |
| D. | 化合物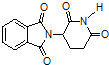 在氢氧化钠溶液中加热后有NH3生成 在氢氧化钠溶液中加热后有NH3生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
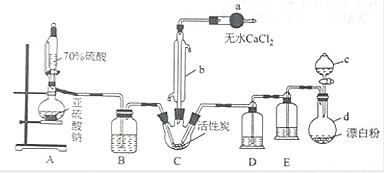 氯化法是合成硫酰氯(SO2Cl2)的常用方法,实验室合成硫酰氯(SO2Cl2)的实验装置如图所示:
氯化法是合成硫酰氯(SO2Cl2)的常用方法,实验室合成硫酰氯(SO2Cl2)的实验装置如图所示:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com