
【题目】已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数依次增大。其中A原子核外有三个未成对电子;A与B可形成离子化合物B3A2;C元素是地壳中含量最高的金属元素;D原子核外的M层中有两对成对电子;E原子核外最外层只有1个电子,其余各层电子均充满。请根据以上信息,回答下列问题(答题时,A、B、C、D、E用所对应的元素符号表示):
(1)E的价电子排布式是_____,A、B、C、D的第一电离能由小到大的顺序_____。
(2)B的氯化物的熔点远高于C的氯化物的熔点,理由是__________;
(3)D的低价氧化物分子的空间构型是_______。
(4)A、E形成某种化合物的晶胞结构如图所示,则其化学式为_______________;(每个球均表示1个原子,白球为A,黑球为E) 若相邻A原子和E原子间的距离为a nm,阿伏加德罗常数为NA,则该晶体的密度为_____________g/cm3(用含a、NA的符号表示)。
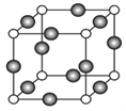
【答案】3d104s1 Al<Mg<S<N MgCl2为离子晶体而A1C13为分子晶体 V形 Cu3N 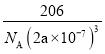
【解析】
A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数依次增大。A原子核外有三个未成对电子,则A为氮(N);A与B可形成离子化合物B3A2,则B为镁(Mg);C元素是地壳中含量最高的金属元素,则C为铝(Al);D原子核外的M层中有两对成对电子,则D为硫(S);E原子核外最外层只有1个电子,其余各层电子均充满,则E为铜(Cu)。
由以上分析可知,A、B、C、D、E分别为N、Mg、Al、S、Cu。
(1)E为铜,其位于第四周期第ⅠB族,价电子排布式是3d104s1,A、B、C、D分别为N、Mg、Al、S,总的来说,非金属性越强,第一电离能越大,但由于Mg的3s轨道半充满,所以第一电离能大于Al,从而得出第一电离能由小到大的顺序为Al<Mg<S<N。答案为:3d104s1;Al<Mg<S<N;
(2)MgCl2由离子构成,微粒间作用力为离子键,AlCl3由分子构成,微粒间作用力为范德华力,MgCl2的熔点远高于AlCl3的熔点,理由是MgCl2为离子晶体而A1C13为分子晶体。答案为:MgCl2为离子晶体而A1Cl3为分子晶体;
(3)D的低价氧化物为SO2,S的价层电子对数为3,分子的空间构型是V形。答案为:V形;
(4)在Cu、N形成晶体的晶胞结构中,含N原子个数为8×![]() =1,含Cu原子个数为12×
=1,含Cu原子个数为12×![]() =3,则其化学式为Cu3N;若相邻N原子和Cu原子间的距离为a nm,则晶胞参数为2 a nm,阿伏加德罗常数为NA,则该晶体的密度为
=3,则其化学式为Cu3N;若相邻N原子和Cu原子间的距离为a nm,则晶胞参数为2 a nm,阿伏加德罗常数为NA,则该晶体的密度为![]() =
=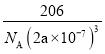 g/cm3。答案为:
g/cm3。答案为: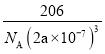 。
。


科目:高中化学 来源: 题型:
【题目】某烷烃的结构简式是CH3CH2CH(CH2CH3)CH3,它的正确命名是
A. 2-乙基丁烷 B. 3-乙基丁烷
C. 3-甲基戊烷 D. 2,2-二甲基丁烷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是中学化学中常见物质之间的一些反应关系,其中部分产物未写出。常温下X是固体,B和G是液体,其余均为气体。根据下图关系推断:

(1)写出化学式:X_______,A________,B_______。
(2)实验室收集气体D和F的方法依次是_______法、________法。
(3)写出C→E的化学方程式:____________。
(4)请写出A与E反应生成D的化学方程式:_______________
(5)检验物质A的方法和现象是________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲是短周期元素中原子半径最小的元素,乙的气态氢化物的水溶液显碱性,丙是短周期元素中原子半径最大的元素,丁是地壳中含量最多的金属元素。
(1)写出四种元素的名称:甲______,乙______,丙______,丁______。
(2)乙、丙、丁三种元素的原子半径从大到小的顺序是________(填元素符号,下同)![]() ________
________![]() ________。
________。
(3)写出乙、丙、丁的最高价氧化物对应的水化物相互反应的化学方程式:__________________、__________________、__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】废旧光盘金属层中含有金属Ag(其他金属微量忽略不计),从光盘中提取金属Ag的工艺流程如下。请回答下列问题:
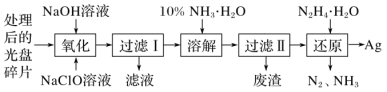
(1)“氧化”阶段需在80℃条件下进行,使用的加热方式为_________。
(2)NaClO溶液与Ag反应的产物为AgCl、NaOH和O2,该反应的化学方程式为________。有人提出用HNO3代替NaClO氧化Ag,从反应产物的角度分析,其缺点是_________。
(3)“过滤Ⅰ”中洗涤难溶物的实验操作为__________。
(4)常用10%的氨水溶解AgCl固体,AgCl与NH3·H2O按1∶2反应可生成Cl-和一种阳离子______(填离子符号)的溶液。实际反应中,即使氨水过量,“废渣”中也含有少量AgCl固体,可能的原因是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋资源开发前景十分广阔。海水晒盐能够得到粗盐和卤水,卤水中含有MgCl2、KCl和MgSO4等物质,右图是它们的溶解度曲线。则下列说法不正确的是

A.t1℃时,三种物质的饱和溶液中,溶质质量分数最大的是MgCl2
B.t1℃时,分别在100g水中溶解了等质量的MgCl2、KCl,两溶液都可达到饱和
C.t2℃时,KCl和MgSO4两种物质的溶解度相同
D.将卤水加热到t2℃ 以上,析出的晶体主要为MgSO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种气态烷烃和一种气态烯烃,它们分子里的碳原子数相等.将1.0体积这种混合气体在氧气中完全燃烧,生成2.0体积的CO2和2.4体积的水蒸气(气体体积均在相同状况下测定),则混合气体中烷烃和烯烃的体积比为( )
A.3:1 B.1:3 C.2:3 D.3:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组有机化合物中,不论两者以什么比例混合,只要总物质的量一定,则完全燃烧时消耗氧气的质量不变的是( )
A.CH4O,C3H4O5,C2H4O2B.C3H6,C3H8O,C4H8O3
C.C3H8,C4H6,C4H8OD.C2H6,C4H6O,C3H8O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将铂电极放置在KOH溶液中,然后分别向两极通入CH4和O2,即可产生电流,此装置称为甲烷燃料电池。下列叙述中正确的是( )
①通入CH4的电极为正极;
②正极的电极反应式为:O2+2H2O+4eˉ=4OHˉ;
③放电时溶液中的阳离子向正极移动;
④负极的电极反应式为:CH4+10OHˉ-8eˉ=![]() +7H2O;
+7H2O;
⑤电子迁移方向:通入CH4的铂电极→通入O2的铂电极→电解质溶液→通入CH4的铂电极
A.①③⑤B.②③④C.②④⑤D.①②③
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com