
【题目】下列物质中属于有机物的是
A.碳酸 B.二氧化碳 C.乙醇汽油 D.甲烷
 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案科目:高中化学 来源: 题型:
【题目】无色气体N2O4是一种强氧化剂,为重要的火箭推进剂之一。N2O4与NO2转换的热化学方程式为:N2O4(g) ![]() 2 NO2(g) △H=+24.4 kJ/mol
2 NO2(g) △H=+24.4 kJ/mol
(1)将一定量N2O4投入固定容积的真空容器中,下述现象能说明反应达到平衡的是_________________。
a.v正(N2O4)=2 v逆(NO2) b.体系颜色不变
c.气体平均相对分子质量不变 d.气体密度不变
达到平衡后,保持体积不变升高温度,再次到达平衡时,则混合气体颜色________(填 “变深”、“变浅”或“不变”)。
(2)平衡常数K可用反应体系中气体物质分压表示,即K表达式中用平衡分压代替平衡浓度,分压=总压×物质的量分数(例如:p(NO2)=p总·x(NO2)。写出上述反应平衡常数Kp表达式________________(用p总、各气体物质的量分数x表示);影响Kp的因素是____________________。
(3)上述反应中,正反应速率v正=k正·p(N2O4),逆反应速率v逆=k逆·p 2(NO2),其中k正、k逆为速率常数,则Kp为_________(以k正、k逆表示)。若将一定量N2O4投入真空容器中恒温恒压分解(温度298 K、压强100 kPa),已知该条件下k正=4.8×l04 s-1 ,当N2O4分解10%时,v正=___________kPa·s-1。
(4)真空密闭容器中放入一定量N2O4,维持总压强p0恒定,在温度为T时,平衡时N2O4分解百分率为a。保持温度不变,向密闭容器中充入等量N2O4,维持总压强在2p0条件下分解,则N2O4的平衡分解率的表达式为_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中,反应2SO2(g)+O2(g)= 2SO3(g) 达到平衡后,若将容器体积缩小一半,对反应产生的影响是
A. V(正)减小,V(逆)增大 B. V(正)增大,V(逆)减小
C. V(正)、V(逆)都减小 D. V(正)、V(逆)都增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20mL的某稀H2S04溶液中滴入0.1mol/L氨水,溶液中水电离出氢离子浓度随滴人氨水体积变化如图。下列分析正确的是( )
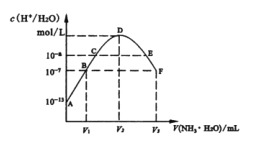
A.稀硫酸的浓度为0.1mol/L
B.C点溶液pH=14-a
C.E溶液中存在:c(NH4+)>c(SO42-)>c(H+)>c(OH-)
D.B到D、D到F所加氨水体积一定相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢气用于烟气的脱氮、脱硫的反应 4H2(g)+2NO(g)+ SO2(g) ![]() N2(g)+S(l)+4H2O(g) ΔH﹤0 。下列有关说法正确的是
N2(g)+S(l)+4H2O(g) ΔH﹤0 。下列有关说法正确的是
A.当v(H2)= v(H2O)时,达到平衡
B.升高温度,正反应速率减小,逆反应速率增大,化学平衡逆向移动
C.使用高效催化剂可提高NO的平衡转化率
D.化学平衡常数表达式为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知一种c(H+)=1×10-3mol/L的酸和一种c(OH-)=1×10-3mol/L的碱溶液等体积混合后溶液呈酸性,其原因可能是( )
A.浓的强酸和稀的强碱溶液反应
B.浓的弱酸和稀的强碱溶液反应
C.等浓度的强酸和弱碱溶液反应
D.生成了一种强酸弱碱盐
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应PCl5(g)![]() PCl 3(g)+Cl2(g) ①
PCl 3(g)+Cl2(g) ①
2HI(g)![]() H2(g)+I2(g) ②
H2(g)+I2(g) ②
2NO2(g)![]() N2O4(g) ③
N2O4(g) ③
在一定条件下,达到化学平衡时,反应物的转化率均是a%。若保持各自的温度不变、体积不变,分别再加入一定量的各自的反应物,则转化率
A.均不变 B.均增大
C.①增大,②不变,③减少 D.①减少,②不变,③增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分析城市空气样本,主要污染物为可吸入颗粒物pm2.5、NOx、SO2等,其主要来源为燃煤和机动车尾气排放等。
(1) 某同学为检测样本中所含成份,将样本用蒸馏水处理制成待测试样,设计实验及实验现象如下:
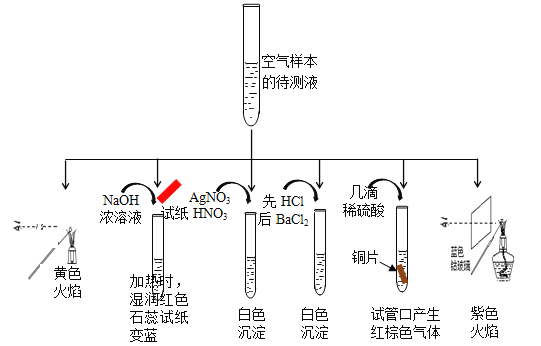
①该实验能确认存在的阳离子是 。
②该实验检测出样本中有NO3-,根据是(用化学方程式解释) 。
③根据该实验能否确定样本中含有SO32-, (填“能”或“否”) ,若要确定SO32-,所需的实验药品可以是 。
(2)PM2.5是指大气中直径小于或等于2.5μm(1μm =103 nm)的颗粒物。下列说法不正确的是 (填字母序号)。
a.PM2.5主要来源于火力发电、工业生产、汽车尾气排放等过程
b.PM2.5颗粒小,所以对人体无害
c.直径介于1 ~2.5μm的颗粒物分散到空气中可形成胶体
d.推广使用电动汽车,可以减少PM2.5的污染
(3)科研工作者用五年时间研究出利用石灰乳除工业燃煤尾气中的硫(SO2、SO3)和氮(NO、NO2)的新工艺,既能净化尾气,又能获得应用广泛的CaSO4和Ca(NO2)2。
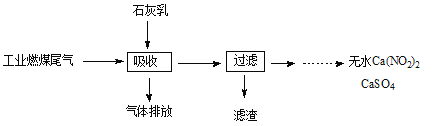
①CaSO4可以调节水泥的硬化时间。尾气中SO2与石灰乳反应生成CaSO4的化学方程式为 。
②Ca(NO2)2可制成混凝土防冻剂、钢筋阻锈剂等。尾气中NO、NO2与石灰乳反应生成Ca(NO2)2的化学方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应A2+ B2= 2AB的能量变化如图所示,则下列说法正确的是( )

A. 该反应是吸热反应
B. 断裂1 mol A—A键和1 mol B—B键能放出x kJ的能量
C. 断裂2 mol A—B键需要吸收y kJ的能量
D. 2 mol AB的总能量高于1 mol A2和1 mol B2的总能量
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com