
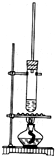
 已知1-丁醇的沸点为117.7℃,乙酸的沸点为118℃,甲同学拟在浓硫酸作用下,使1-丁醇和乙酸进行酯化反应制乙酸丁酯(反应温度115~125℃)
已知1-丁醇的沸点为117.7℃,乙酸的沸点为118℃,甲同学拟在浓硫酸作用下,使1-丁醇和乙酸进行酯化反应制乙酸丁酯(反应温度115~125℃)分析 (1)1-丁醇的沸点为117.7℃,乙酸的沸点为118℃,都比水的沸点高,且防止温度过高而炭化;
(2)加入乙酸,可提高丁醇的转化率;
(3)根据水与酯类物质互不相溶的性质分析;
(4)混合物没有固定的熔沸点;
(5)乙酸具有酸性,可与CaO等碱性物质反应,利于分馏分离;
(6)实验室制备硝基苯需要加热到50~60℃;制备乙烯需要加热到170℃.
解答 解:(1)1-丁醇的沸点为117.7℃,乙酸的沸点为118℃,都比水的沸点高,则不能用水浴的方法加热,否则达不到反应温度,火焰不与试管接触,可防止直接加热到导致碳化,
故答案为:反应温度为115~125℃不能水浴,直接加热容易炭化;
(2)加入乙酸,可提高丁醇的转化率,且乙酸相对价格较为便宜,故答案为:乙酸相对廉价,提高1-丁醇的转化率;
(3)乙酸丁酯与水互不相溶,可从任意一层取少量液体加水,如混溶则盖层为水层,不混溶则为有机层,
故答案为:从任意一层取少量液体加水,如混溶则盖层为水层,不混溶则为有机层;
(4)混合物没有固定的熔沸点,可通过测定产品的沸点判断,如有固定的沸点,则为纯净物,否则不是,故答案为:测定产品的沸点;
(5)乙酸具有酸性,可与CaO等碱性物质反应,让乙酸反应后生成高沸点的离子化合物,利于分馏分离,
故答案为:生石灰;让乙酸反应后生成高沸点的离子化合物;
(6)实验室制备硝基苯需要加热到50~60℃;制备乙烯需要加热到170℃,而制备溴苯无需加热,而银镜反应可用沸水浴,无需加热,
故答案为:a、c.
点评 本题考查有机物的制备,为高频考点,侧重于学生的分析、实验能力的考查,题目着重考查实验的方法、原理以及注意事项,有利于培养学生良好的实验能力和科学素养,难度中等.


 考前必练系列答案
考前必练系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
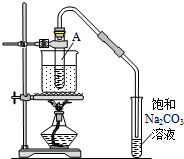 按如图所示装置,在试管A里加入3mL乙醇和2mL冰醋酸,然后一边摇动,一边慢慢地加入2mL浓硫酸,再加入少量碎瓷片,用酒精灯加热10min,结果在饱和碳酸钠溶液的液面上没有无色油状液体,下列对其原因的分析错误的是( )
按如图所示装置,在试管A里加入3mL乙醇和2mL冰醋酸,然后一边摇动,一边慢慢地加入2mL浓硫酸,再加入少量碎瓷片,用酒精灯加热10min,结果在饱和碳酸钠溶液的液面上没有无色油状液体,下列对其原因的分析错误的是( )| A. | 试管A中没有发生反应 | |
| B. | 热源小、水量多,水浴升温速度太慢 | |
| C. | 产物蒸汽在试管A上部全部被冷凝回流 | |
| D. | 产物已全部溶解在饱和Na2CO3溶液中 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | pH=2的HA溶液与pH=12的MOH溶液任意比混合:c(H+)+c(M+)=c(OH-)+c(A-) | |
| B. | B氨水和盐酸混合后溶液呈酸性,溶液中可能存在:c(NH4+)>c(Cl-) | |
| C. | 在一定温度下,相同pH的硫酸和硫酸铁溶液中水电离出来的c(H+)分别是1.0×0×10-amol/L和是1.0×10-bmol/L,在此温度时,水的离子积为1.0×10-(a+b) | |
| D. | 常温下,0.1mol/L酸HA pH=3,0.1mol/L 碱BOH pH=13,则盐BA溶液的pH<7 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某研究性学习小组为了证明在同温同压下,相同浓度相同体积的酸性不同的一元酸与足量镁带反应时,生成氢气的体积相同而反应速率不同,同时测定实验室条件下的气体摩尔体积.设计的简易实验装置如图所示.该实验的主要操作步骤如下:
某研究性学习小组为了证明在同温同压下,相同浓度相同体积的酸性不同的一元酸与足量镁带反应时,生成氢气的体积相同而反应速率不同,同时测定实验室条件下的气体摩尔体积.设计的简易实验装置如图所示.该实验的主要操作步骤如下:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 酸 | 电离方程式 | 电离常数 K/mol•L-1 |
| CH3COOH | CH3COOH?CH3COO-+H+ | 1.26×10-5 |
| H2CO3 | H2CO3?H++HCO3- HCO3-?CO32-+H+ | K1=4.31×10-7 K2=5.61×10-11 |
| H2S | H2S?H++HS- HS-?H++S2- | K1=9.1×10-8 K2=1.1×10-12 |
| H3PO4 | H3PO4?H++H2PO4- H2PO4-?H++HPO42- HPO42-?H++PO43- | K1=7.52×10-3 K2=6.23×10-8 K3=2.20×10-13 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=12的Ba(OH)2 | B. | pH=12的NH3•H2O | ||
| C. | 0.05 mol/L的NaOH | D. | 0.05 mol/L的BaCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com