解:(1)在该反应中硝酸反应生成硝酸盐,且硝酸中N元素的化合价降低,则作氧化剂,硝酸在反应中被还原,则对应的产物NO、NO
2为还原产物,
故答案为:氧化剂、酸;NO、NO
2;
(2)该反应中Cu元素由0价升高到+2价,则失去的电子为0.3mol×(2-0)×N
Amol
-1=0.6N
A个,
设NO的物质的量为n,得到的NO和NO
2物质的量相同,
由电子守恒可知,0.3mol×2=n×(5-2)+n×(5-4),
解得n=0.15mol,
则N原子守恒可知作氧化剂的硝酸为0.15mol+0.15mol=0.3mol,
由Cu(NO
3)
2可知,作酸性的硝酸为0.3mol×2=0.6mol,
则参加反应的硝酸的物质的量是0.3mol+0.6mol=0.9mol,
由3NO
2+H
2O═2HNO
3+NO可知,0.15molNO
2与水反应生成0.05molNO,
则用排水法收集这些气体,最后气体为NO,其物质的量为0.15mol+0.05mol=0.2mol,
在标准状况下,气体的体积为0.2mol×22.4L/mol=4.48L,故答案为:0.6N
A;0.9mol;4.48L;
(3)Cu+HNO
3→Cu(NO
3)
2+NO↑+NO
2↑+H
2O中,参加反应的Cu和HNO
3的物质的量之比是3:10,
则3Cu+10HNO
3→3Cu(NO
3)
2+xNO↑+yNO
2↑+5H
2O,
由电子守恒及N原子守恒可得,
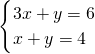
,解得x=1,y=3,
则配平的化学反应为3Cu+10HNO
3═3Cu(NO
3)
2+NO↑+3NO
2↑+5H
2O,
单质、气体、水在离子方程式中保留化学式,其离子反应为3Cu+10H
++4NO
3-→3Cu
2++NO↑+3NO
2↑+5H
2O,
故答案为:3Cu+10H
++4NO
3-→3Cu
2++NO↑+3NO
2↑+5H
2O;
(4)该反应中硝酸被还原,生成两种还原产物,两者的比例和氧化剂、还原剂的用量都可以发生变化,
则方程式可能的配平系数有许多组,故答案为:该反应式含两种还原产物,两者的比例和氧化剂、还原剂的用量都可以发生变化.
分析:(1)根据硝酸反应生成硝酸盐及硝酸中N元素的化合价变化来分析;
(2)根据Cu元素的化合价变化来分析失去电子数,利用电子守恒来计算作氧化剂的硝酸的物质的量,作酸性和作氧化剂的物质的量之和为参加反应的硝酸的物质的量,再根据NO不溶于水,3NO
2+H
2O═2HNO
3+NO;
(3)根据电子守恒及质量守恒定律来并配平该反应的离子方程式;
(4)根据该反应中硝酸被还原,生成两种还原产物来分析.
点评:本题考查氧化还原反应,明确反应中元素的化合价变化来分析氧化还原反应是关键,并利用电子守恒、质量守恒定律等来进行相关计算即可解答,(4)是学生解答的难点.

 ,解得x=1,y=3,
,解得x=1,y=3,


 4NO+6H2O
4NO+6H2O 4NO+6H2O
4NO+6H2O +HNO3(浓)
+HNO3(浓) -NO2+H2O
-NO2+H2O +HNO3(浓)
+HNO3(浓) -NO2+H2O
-NO2+H2O