
【题目】下列说法正确的是
A.O2、O3互为同位素
B.1H、2H、3H、H+、H2是氢元素形成的五种不同粒子
C.正丁烷和异丁烷互为同系物
D.乙烷、乙烯互为同分异构体
科目:高中化学 来源: 题型:
【题目】用0.55 mol·L-1 NaOH溶液分别与0.5 mol·L-1的盐酸、醋酸溶液反应,且所取的溶液体积均相等,测出的中和热数值分别为ΔH1和ΔH2,则ΔH1和ΔH2两者的关系正确的是( )
A.ΔH1>ΔH2B.ΔH1=ΔH2C.ΔH1<ΔH2D.无法比较
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列说法中正确的是
A. 4g重水(D2O)中所含质子数为0.2NA
B. 4.48L N2与CO的混合物所含分子数为0.2NA
C. 6.2g白磷与红磷的混合物中所含磷原子数为0.2NA
D. 12.5mL 16mol·L-1浓硫酸与足量铜反应,转移电子数为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在配制一定物质的量浓度的盐酸时,下列错误操作可使所配制溶液浓度偏高的是 ( )
A. 用量筒量取浓盐酸时仰视读数B. 溶解搅拌时有液体飞溅
C. 定容时仰视容量瓶瓶颈刻度线D. 摇匀后见液面下降,再加水至刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用所学知识填写下列空白:(填代号)
(1)下列物质:①金属铜 ②固态NaCl ③液氧 ④盐酸 ⑤碳棒 ⑥酒精 ⑦KOH水溶液 ⑧熔融状态的KNO3 ⑨葡萄糖 ⑩天然气
属于电解质的是__________;属于非电解质是__________;能导电的化合物是__________。
(2)常温下,将1mLpH=1的H2SO4的溶液加水稀释到100mL,稀释后的溶液中c(SO42-)∶c(OH-) =_______________;
(3)某温度时,测得0.01 molL-1 NaOH溶液的pH为11,则该温度下水的离子积常数Kw=______。在该温度下,将pH=a的NaOH溶液Va L与pH=b的硫酸Vb L混合.若所得混合液为中性,且a=12,b=2,则Va:Vb=______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室中有一未知浓度的稀盐酸,某同学在实验室中进行实验测定盐酸的浓度。请完成下列填空:
(1)配制100mL0.10molL-1 NaOH标准溶液。
① 主要操作步骤:计算→称量→溶解→_______(冷却后)→洗涤(并将洗涤液移入容量瓶)→定容→摇匀→将配制好的溶液倒入试剂瓶中,贴上标签。
② 称量_____g氢氧化钠固体所需仪器有:天平(带砝码、镊子)、________、烧杯(或表面皿)。
(2)取20.00 mL待测盐酸放入锥形瓶中,并滴加23滴酚酞作指示剂,用配制的标准NaOH溶液进行滴定。重复上述滴定操作23次,记录数据如下:
实验编号 | NaOH溶液的浓度(molL-1) | 滴入NaOH溶液的体积(mL) | 待测盐酸的体积(mL) |
1 | 0.10 | 22.62 | 20.00 |
2 | 0.10 | 22.72 | 20.00 |
3 | 0.10 | 22.80 | 20.00 |
①碱式滴定管用蒸馏水洗净后,接下来应该进行的操作是________________________________。
②下列试剂①HF溶液 ②KMnO4溶液 ③乙醇 ④CH3COONa溶液,其中_____________(填序号)
不能用酸式滴定管来盛装
③该实验滴定达到终点的标志是_______________________________。
④根据上述数据,可计算出该盐酸的浓度约为_________________(保留两位有效数字)
⑤接近滴定终点时由于滴速过快,如何确定标准液是否滴加过量?_______________________
⑥在上述实验中,下列操作(其他操作正确)会造成测定结果偏高的有_______________________
A.滴定终点读数时俯视读数 B.酸式滴定管使用前,水洗后未用待测盐酸润洗
C.锥形瓶水洗后未干燥 D.碱式滴定管尖嘴部分有气泡,滴定后消失
E.称量NaOH固体时,混入少量KOH杂质
⑦现用以上实验配制的0.10 molL-1NaOH溶液测定食醋中乙酸的浓度,应该选用的试剂为__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知H2O2在催化剂作用下分解速率加快,其能量随反应进程的变化如图所示.下列说法正确的是( ) 
A.加入催化剂,减小了反应的热效应
B.加入催化剂,可提高H2O2的平衡转化率
C.H2O2分解的热效应△H<0
D.反应物的总能量高于生成物的总能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电影《闪闪的红星》中,为让被困的红军战士吃上食盐,潘冬子将浸透食盐水的棉袄裹在身上,带进山中。假如潘冬子在实验室中,欲从食盐水中提取出食盐,采用的最好方法是( )
A. 过滤 B. 萃取 C. 蒸发 D. 蒸馏
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用LiOH和钴氧化物可制备锂离子电池正极材料.LiOH可由电解法制备,钴氧化物可通过处理钴渣获得. 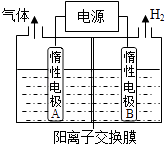
(1)利用如图装置电解制备LiOH,两电极区电解液分别为LiOH和LiCl溶液.B极区电解液为溶液(填化学式),阳极电极反应式为 , 电解过程中Li+向电极迁移(填“A”或“B”).
(2)利用钴渣[含Co(OH)3、Fe(OH)3等]制备钴氧化物的工艺流程如下: 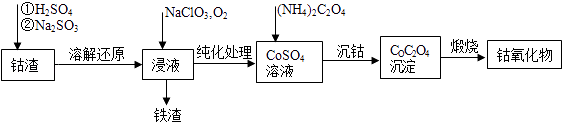
Co(OH)3溶解还原反应的离子方程式为 , 铁渣中铁元素的化合价为 , 在空气中煅烧CoC2O4生成钴氧化物和CO2 , 测得充分煅烧后固体质量为2.41g,CO2的体积为1.344L(标准状况),则钴氧化物的化学式为 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com