
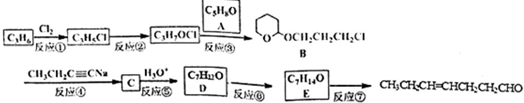
 、CH3CH2C≡CCH2CH2CH2OH;
、CH3CH2C≡CCH2CH2CH2OH; ;
;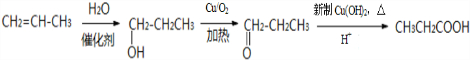 .
. 分析 由B的结构简式、反应物分子式,可知反应③为加成反应,则C3H7OCl为HOCH2CH2CH2Cl,A为 ,可推知C3H6为CH2=CHCH3,与氯气发生取代反应生成C3H5Cl为CH2=CHCH2Cl,再与水发生加成反应得到HOCH2CH2CH2Cl.由给予的信息可知反应④为取代反应,则C为
,可推知C3H6为CH2=CHCH3,与氯气发生取代反应生成C3H5Cl为CH2=CHCH2Cl,再与水发生加成反应得到HOCH2CH2CH2Cl.由给予的信息可知反应④为取代反应,则C为 ,结合D的分子式及CH3CH2CH=CHCH2CH2CHO可知,C水解得到得到D为CH3CH2C≡CCH2CH2CH2OH,D与氢气发生加成反应得到CH3CH2CH=CHCH2CH2CH2OH,再利用弱氧化剂如新制氢氧化铜悬浊液氧化得到CH3CH2CH=CHCH2CH2CHO.
,结合D的分子式及CH3CH2CH=CHCH2CH2CHO可知,C水解得到得到D为CH3CH2C≡CCH2CH2CH2OH,D与氢气发生加成反应得到CH3CH2CH=CHCH2CH2CH2OH,再利用弱氧化剂如新制氢氧化铜悬浊液氧化得到CH3CH2CH=CHCH2CH2CHO.
解答 解:由B的结构简式、反应物分子式,可知反应③为加成反应,则C3H7OCl为HOCH2CH2CH2Cl,A为 ,可推知C3H6为CH2=CHCH3,与氯气发生取代反应生成C3H5Cl为CH2=CHCH2Cl,再与水发生加成反应得到HOCH2CH2CH2Cl.由给予的信息可知反应④为取代反应,则C为
,可推知C3H6为CH2=CHCH3,与氯气发生取代反应生成C3H5Cl为CH2=CHCH2Cl,再与水发生加成反应得到HOCH2CH2CH2Cl.由给予的信息可知反应④为取代反应,则C为 ,结合D的分子式及CH3CH2CH=CHCH2CH2CHO可知,C水解得到得到D为CH3CH2C≡CCH2CH2CH2OH,D与氢气发生加成反应得到CH3CH2CH=CHCH2CH2CH2OH,再利用弱氧化剂如新制氢氧化铜悬浊液氧化得到CH3CH2CH=CHCH2CH2CHO.
,结合D的分子式及CH3CH2CH=CHCH2CH2CHO可知,C水解得到得到D为CH3CH2C≡CCH2CH2CH2OH,D与氢气发生加成反应得到CH3CH2CH=CHCH2CH2CH2OH,再利用弱氧化剂如新制氢氧化铜悬浊液氧化得到CH3CH2CH=CHCH2CH2CHO.
(1)CH3CH2CH=CHCH2CH2CHO的名称为4-庚烯醛,B中所含有的官能团有醚键、氯原子,
故答案为:4-庚烯醛;醚键、氯原子;
(2)①的反应类型是取代反应,⑦的反应类型是氧化反应,
故答案为:取代反应;氧化反应;
(3)A的结构简式为 ,D的结构简式为CH3CH2C≡CCH2CH2CH2OH,
,D的结构简式为CH3CH2C≡CCH2CH2CH2OH,
故答案为: ;CH3CH2C≡CCH2CH2CH2OH;
;CH3CH2C≡CCH2CH2CH2OH;
(4)检验E是否完全转化为目标产物的方法:取样,加入金属钠,无气体产生,
故答案为:取样,加入金属钠,无气体产生;
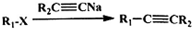
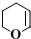
(5)C为 ,M是C的同分异构体,满足以下条件:①无环状结构,②1molM与足量银氨溶液反应可得到4molAg,分子中含有2个-CHO,不饱和度为3,结合①可知还含有碳碳双键,③分子中有2种化学环境不同的氢原子,符合条件的同分异构体为:
,M是C的同分异构体,满足以下条件:①无环状结构,②1molM与足量银氨溶液反应可得到4molAg,分子中含有2个-CHO,不饱和度为3,结合①可知还含有碳碳双键,③分子中有2种化学环境不同的氢原子,符合条件的同分异构体为: ,
,
故答案为: ;
;
(6)丙烯与是发生加成反应得到1-丙醇,再催化氧化得到丙醛,最后氧化得到丙酸,合成路线流程图为: ,
,
故答案为: .
.
点评 本题考查有机物的推断与合成,充分利用有机物的分子式与结构简式进行推断,熟练掌握官能团的性质与转化,侧重考查学生分析推理能力,难度中等.


科目:高中化学 来源: 题型:解答题

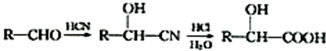
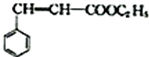
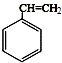 ;C 的化学名称为苯乙醛.
;C 的化学名称为苯乙醛.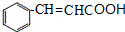 +CH3CH2OH$→_{△}^{浓硫酸}$
+CH3CH2OH$→_{△}^{浓硫酸}$ +H2O.
+H2O.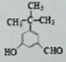
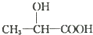 )的路线(其他试剂任选)
)的路线(其他试剂任选)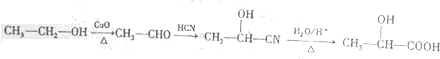 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
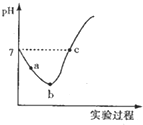 常温下,将Cl2缓慢通入水中至饱和,然后向所得饱和氯水中滴加0.1mol/L的NaOH溶液,整个实验过程中溶液的pH变化曲线如图所示,下列叙述正确的是( )
常温下,将Cl2缓慢通入水中至饱和,然后向所得饱和氯水中滴加0.1mol/L的NaOH溶液,整个实验过程中溶液的pH变化曲线如图所示,下列叙述正确的是( )| A. | 实验过程中可用pH试纸测定溶液的pH | |
| B. | a点的溶液中:C(H+)=c(Cl-)+c(HCl0)+c(OH-) | |
| C. | c 点所示溶液中;c(Na+)=2c(ClO )+c(HCIO) | |
| D. | 由a点到b点的过程中,溶液中$\frac{c({H}^{+})}{c(Cl{O}^{-})}$减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 地沟油不宜食用,可分馏提取汽油 | |
| B. | 二氧化硅具有很好的导电性,可用于制取光导纤维 | |
| C. | 盛有甲醇的试剂瓶上,应贴上 警示标签 警示标签 | |
| D. | 钙、钡、铁、铂等金属有绚丽的颜色,可用于制造焰火 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | A | B | C | D |
| 实验方案 | 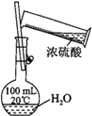 | 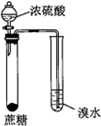 | 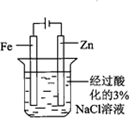 | 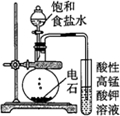 |
| 实验目的 | 配制一定物质的量浓度的硫酸 | 验证浓硫酸具有脱水性、氧化性 | 验证Fe电极被保护 | 用该装置制备并检验乙炔 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 物质 | Mn(OH)2 | Co(OH)2 | Ni(OH)2 | MnS | CoS | NiS |
| Ksp | 2.1×10-13 | 3.0×10-16 | 5.0×10-16 | 1.0×10-11 | 5.0×10-22 | 1.0×10-22 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
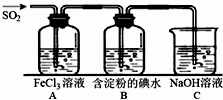 二氧化硫是硫的重要化合物,在生产、生活中有广泛应用,是大气主要污染物之一,具有一定的还原性,探究SO2气体还原Fe3+、I2,可以使用的药品和装置如图所示:
二氧化硫是硫的重要化合物,在生产、生活中有广泛应用,是大气主要污染物之一,具有一定的还原性,探究SO2气体还原Fe3+、I2,可以使用的药品和装置如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 如图所示,打开分液漏斗后,加热,烧杯中出现黄色沉淀并有臭鸡蛋气味的气体逸出,则原烧杯中n(Na2S)与n(Na2SO3)的比值需满足( )
如图所示,打开分液漏斗后,加热,烧杯中出现黄色沉淀并有臭鸡蛋气味的气体逸出,则原烧杯中n(Na2S)与n(Na2SO3)的比值需满足( )| A. | >2 | B. | <2 | C. | =2 | D. | 1~2之间 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com