
【题目】分类是学习和研究化学物质及其变化的一种常用的科学方法。
(1)下列4组物质中均有一种物质的主要化学性质与其他3种不同。
A.CaO、Na2O、CO2、MgO B.CH3COOH、H2SO4、Ba(OH)2、HNO3
C.H2、Cl2、P、Cu D.HCl、CH3CH2OH、H2SO3、HNO3
①写出D组中不同于其他三种的物质的化学式:______________。
②A组中的一种物质与B组中的一种物质反应,反应物的量不同产物有所不同。写出这两种物质反应有沉淀产生的离子反应方程式:____________________________。
③C组中Cu在一定条件下可与H2、Cl2、P反应生成CuH、CuCl2、Cu3P等化合物。写出CuH在Cl2中燃烧的化学方程式:___________________________________。
(2)NaOH、Na2CO3、NaAlO2溶液都具有碱性。向500mL由NaOH、Na2CO3、NaAlO2组成的混合溶液中滴加0.2mol·L-1盐酸,所消耗盐酸体积如图所示,回答下列问题:
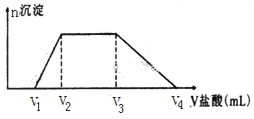
①写出加盐酸V1至V2段反应的离子方程式:_______________________________。
②用36.5%(密度为1.19g·mL-1)的浓盐酸配制945mL0.2mol·L-1盐酸,需要量取的浓盐酸体积为___________________。
③若V1=50mL,V2=100mL,V3=200mL,则V4=___________。原混合溶液中NaOH、Na2CO3、NaAlO2的物质的量之比为______________。
【答案】 C2H5OH CO2+Ba2++2OH-===BaCO3↓+H2O 2CuH+3Cl2 ![]() 2CuCl2+2HCl AlO2-+H++H2O==Al(OH)3↓ 16.8mL 350mL 1:1:1
2CuCl2+2HCl AlO2-+H++H2O==Al(OH)3↓ 16.8mL 350mL 1:1:1
【解析】(1)①HCl、H2SO3、HNO3均具有酸性,而CH3CH2OH为有机物,显中性;正确答案:CH3CH2OH。
②A组中的CO2与B组中的Ba(OH)2反应的量不同,产物有所不同;当少量CO2与Ba(OH)2溶液反应时,生成碳酸钡沉淀和碳酸钠,离子反应方程式:CO2+Ba2++2OH-===BaCO3↓+H2O ;正确答案:CO2+Ba2++2OH-===BaCO3↓+H2O。
③根据氧化还原反应规律,Cl元素由0价降低到-1价,铜元素由+1价升高到+2价,氢元素由-1价升高到+1价,所以CuH在Cl2中燃烧生成氯化铜和氯化氢,化学方程式为2CuH+3Cl2 ![]() 2CuCl2+2HCl;正确答案:2CuH+3Cl2
2CuCl2+2HCl;正确答案:2CuH+3Cl2 ![]() 2CuCl2+2HCl。
2CuCl2+2HCl。
(2)①V1之前为盐酸中和NaOH,V1至V2段生成沉淀的过程且达到最大值,只有偏铝酸根离子与氢离子反应生成氢氧化铝沉淀,离子方程式:AlO2-+H++H2O==Al(OH)3↓;正确答案:AlO2-+H++H2O==Al(OH)3↓。
②浓盐酸的浓度为1000×ρ×ω/M=(1000×1.19×36.5%)/36.5=11.9mol/L,配制945 mL0.2mol·L-1盐酸,需要用1000 mL容量瓶;根据溶液稀释前后溶质的量不变的规律可知: 11.9×V(浓盐酸)= 0.2×1000×10-3, V(浓盐酸)= 16.81mL;正确答案:16.81。
③根据反应AlO2-+H++H2O==Al(OH)3↓,Al(OH)3+ 3H+= Al3++2 H2O,产生沉淀和溶解沉淀所需的盐酸体积之比为1:3,则V4=200+50×3=350 mL,再根据H++OH-= H2O,CO32-+2H+= H2O+CO2↑,盐酸与NaOH、Na2CO3、NaAlO2溶液反应时分别所用的体积之比为1:2:1,则三种物质的物质的量之比1:1:1;正确答案:350 mL;1:1:1。


科目:高中化学 来源: 题型:
【题目】下列原子半径的大小顺序正确的是( )
①2s22p2 ②3s23p3 ③2s22p4 ④3s23p2
A. ③>④>②>① B. ④>③>②>①
C. ④>③>①>② D. ④>②>①>③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是( )
A. 136g熔融的KHSO4中含有2NA个阳离子
B. 40gH218O与40gD2O所含的中子数均为20NA
C. 1molFe分别与足量的稀硫酸和稀硝酸反应转移电子数均为2NA
D. 标准状况下,22.4LNO和11.2LO2混合后气体的分子总数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(能力挑战题)已知五种元素的原子序数的大小顺序为C>A>B>D>E;A、C同周期,B、C同主族;A与B形成的离子化合物A2B中所有离子的电子数相同,其电子总数为30,D和E可形成4核10个电子分子。试回答下列问题:
(1)写出五种元素的名称。
A ,B ,C ,D ,E 。
(2)用电子式表示离子化合物A2B的形成过程:_________ ____________。
(3)写出D元素形成的单质的结构式: ____________________。
(4)写出下列物质的电子式:
E与B形成的化合物: ;A、B、E形成的化合物: ;D、E形成的化合物: ___________。
(5)A、B两元素组成的化合物A2B2属于 (填“离子”或“共价”)化合物,存在的化学键是 ,写出A2B2与水反应的化学方程式___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是实验室常用的装置,请根据要求回答问题:
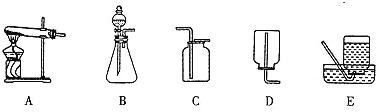
(1)实验室用氯酸钾和二氧化锰制取氧气的化学方程式为________________________,选用的气体发生装置是_________(填装置序号)。反应结束后,若要过滤分离出二氧化锰,除了玻璃棒外,还需要补充的玻璃仪器名称是__________、__________。
(2)实验室可用氧化钙固体与浓氨水在常温下混合制取氨气(NH3),选用的气体发生装置是________(填装置序号)。
(3)上图中的C、D、E三种装置,均可用下图的F装置代替。若用F装置进行排空气法收集二氧化碳,二氧化碳应从F装置的_______(填“a”或“b”,下同)口通入;若用F装置进行排水法收集氧气,可先在F装置中装满水,然后将氧气从F装置的_______口通入。

(4)将二氧化碳通入紫色石蕊溶液中,溶液变成红色,加热后溶液又变成紫色。用化学方程式表示加热后溶液又变成紫色的原因是_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中,正确的是( )
A.水和冰互为同素异形体B.35Cl和37Cl互为同位素
C.白磷与红磷互为同位素D.CH4和CH3CH3互为同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中,若忽略水的电离,只含有下表中所示的四种离子,试推测X离子及其个数b可能为( )
离子 | Na+ | Al3+ | Cl﹣ | X |
个数 | 2a | a | a | b |
A.NO3﹣、2a
B.SO42﹣、2a
C.OH﹣、2a
D.SO42﹣、4a
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】S转化为H2SO4有下列两种途径,部分反应条件和产物已省略。
途径①:S![]() H2SO4
H2SO4
途径②:S![]() SO2
SO2![]() SO3
SO3![]() H2SO4
H2SO4
下列有关说法不正确的是 ( )
A. 途径①的反应体现了浓硝酸的强氧化性和酸性
B. 途径②中有两步氧化还原反应
C. 由途径①和②分别制取1 mol H2SO4,理论上各消耗1 mol S,各转移6 mol电子
D. 理论上,途径②相比途径①对环境的污染小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com