
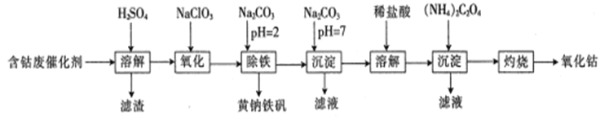
【题目】以含钴废催化剂(主要成分为Co、Fe、SiO2)为原料来制取氧化钴(Co2O3),是我国生产氧化钴常见的工业方法之一。其生产流程如下:
已知:KMnO4的氧化性强,可以氧化HBr、HCl、Fe2+等。
请回答以下问题:
(1)“溶解”前,需将含钴废催化剂粉碎的目的是____________,“溶解”后所得滤渣的主要成分是________________(填化学式)。
(2)“氧化”的目的是将Fe2+氧化成Fe3+,该反应的离子方程式为__________;实验中能否选用KMnO4溶液检验Fe2+是否完全氧化?______ (填“能”或“不能”),理由是______________________________。
(3)“除铁”步骤中,当Fe3+与CO32-的物质的量相等时,恰好完全反应生成黄钠铁矾[Na2Fe6(SO4)4(OH)12]沉淀,写出该反应的化学方程式:_____________
(4)加入Na2CO3溶液后生成“沉淀”,过滤后需用水洗涤沉淀,检脸沉淀已经洗涤干净的方法是______________
(5)现取10.0g含钴废催化剂(含钴的质量分数为70.8%)模拟以上生产流程进行实验,最终得到7.47g氧化钴,则该实验的产率为__________________
【答案】增大接触面积,加快浸取速率 SiO2 6Fe2++6H++ClO3-═6Fe3++Cl-+3H2O 不能 反应后的溶液中含有H+和Cl—,也会使KMnO4溶液褪色 3Fe2(SO4)3+6H2O+6Na2CO3=Na2Fe6(SO4)4(OH)12↓+5Na2SO4+6CO2↑ 取最后一次洗涤液,加入盐酸酸化的氯化钡溶液,若没有沉淀生成,说明沉淀洗涤干净 75%
【解析】
由流程图可知,向含钴废催化剂中加入稀硫酸,钴和铁与硫酸反应,反应的化学方程式为Co+H2SO4=CoSO4+H2↑、Fe+H2SO4=FeSO4+H2↑,二氧化硅与稀硫酸不反应,过滤,滤渣是不溶的二氧化硅,而滤液是硫酸钴、硫酸亚铁与过量的硫酸的混合溶液;向滤液中加入氯酸钠,氯酸钠具有氧化性,酸性条件下将亚铁离子氧化成铁离子;向反应后溶液中加入碳酸钠,调节溶液pH为2,将溶液中的铁离子转化为黄钠铁矾[Na2Fe6(SO4)4(OH)12]沉淀除去;过滤,向滤液中继续加入碳酸钠,调节溶液pH为7,得到碳酸钴沉淀;过滤,用盐酸溶解碳酸钴沉淀,再向所得溶液中加入草酸铵,得到草酸钴沉淀,过滤,灼烧草酸钴沉淀,草酸钴沉淀与空气中氧气反应生成氧化钴。
(1)“溶解”前,需将含钴废催化剂粉碎,目的是增大固体的表面积,增大含钴废催化剂与稀硫酸的接触面积,加快浸取速率;“溶解”时,钴和铁与硫酸反应,二氧化硅与稀硫酸不反应,则溶解后,过滤所得滤渣的主要成分是SiO2,故答案为:增大接触面积,加快浸取速率;SiO2;
(2)向滤液中加入氯酸钠,氯酸钠具有氧化性,酸性条件下将亚铁离子氧化成铁离子,反应的离子方程式为:6Fe2++6H++ClO3-═6Fe3++Cl-+3H2O;KMnO4的氧化性强,酸性条件下,高锰酸钾能与Cl—发生氧化还原反应,使KMnO4溶液褪色,因氧化后的溶液中含有H+和Cl—,会干扰Fe2+检验,则不能选用KMnO4溶液检验Fe2+是否完全氧化,故答案为:6Fe2++6H++ClO3-═6Fe3++Cl-+3H2O;不能;反应后的溶液中含有H+和Cl—,也会使KMnO4溶液褪色;
(3)“除铁”步骤中,当Fe3+与CO32-的物质的量相等时,生成硫酸铁与碳酸钠发生双水解反应,反应生成黄钠铁矾[Na2Fe6(SO4)4(OH)12]沉淀、硫酸钠和二氧化碳,反应的化学方程式为3Fe2(SO4)3+6H2O+6Na2CO3=Na2Fe6(SO4)4(OH)12↓+5Na2SO4+6CO2↑,故答案为:3Fe2(SO4)3+6H2O+6Na2CO3=Na2Fe6(SO4)4(OH)12↓+5Na2SO4+6CO2↑;
(4)加入Na2CO3溶液,碳酸钠与溶液中钴离子反应生成碳酸钴沉淀,碳酸钴沉淀表面附有可溶的硫酸钠或氯化钠杂质,则可以用盐酸酸化的氯化钡溶液检验最后一次洗涤液是否含有硫酸根,检验测定是否洗涤干净,具体操作为取最后一次洗涤液,加入盐酸酸化的氯化钡溶液,若没有沉淀生成,说明沉淀洗涤干净,故答案为:取最后一次洗涤液,加入盐酸酸化的氯化钡溶液,若没有沉淀生成,说明沉淀洗涤干净;
(5)含钴的质量分数为70.8%的10.0g含钴废催化剂中钴原子的物质的量为![]() =0.12mol,由钴原子个数守恒可知Co2O3的物质的量为0.06mol,则实验的产率为
=0.12mol,由钴原子个数守恒可知Co2O3的物质的量为0.06mol,则实验的产率为![]() ×100%=75%,故答案为:75%。
×100%=75%,故答案为:75%。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】氮氧化物是评价空气质量的控制标准之一,作为空气污染物的氮氧化物(NOx)常指NO和NO2。
(1)下列关于氮氧化物有关叙述不正确的是:_______(填序号)
①对人体及动物有毒害作用;②造成土壤污染;③一氧化氮可结合血红蛋白造成人体缺氧;④是形成酸雨、酸雾的主要原因之一; ⑤增高大气温度;⑥与碳氢化合物形成光化学烟雾;⑦参与臭氧层的破坏;⑧一氧化氮分子作为一种传递神经信息的 信使分子 ,在使血管扩张,免疫,增强记忆力
(2)用CH4催化还原NOx可在一定程度上消除氮氧化物的污染。
已知:CH4(g)+4NO(g) ![]() 2N2(g)+CO2(g)+2H2O(g)的ΔH=-1160kJ·mol-1
2N2(g)+CO2(g)+2H2O(g)的ΔH=-1160kJ·mol-1
2NO2(g)+N2(g) ![]() 4NO(g) ΔH=+293 kJ·mol-1
4NO(g) ΔH=+293 kJ·mol-1
则该条件下,CH4催化还原NO2消除污染的热化学方程式为_______________。
(3)T1℃时,在刚性反应器中以投料比为1:3的NO(g)与O2(g)反应,其中NO2二聚为N2O4的反应可以迅速达到平衡。体系的总压强p随时间t的变化如下表所示[t=∞时,NO(g)完全反应]。
t/min | 0 | 40 | 80 | 160 | 260 | 700 | ∞ |
p/kPa | 32.8 | 30.7 | 29.9 | 29.4 | 29.2 | 28.8 | 26.9 |
①NO(g)与O2(g)合成的反应速率v=4.2×10-2×p2(NO)×p(O2)(kPa·min-1),t=42 min时,测得体系中p(O2)=22.4 kPa,则此时的v=_________kPa·min-1(计算结果保留1位小数)。
②若降低反应温度至T2℃,则NO(g)与O2(g)完全反应后体系压强p∞(T2℃)_________(填“大于”“等于”或“小于”)26.9kPa,原因是___________________________________。
③T1℃时,反应N2O4(g) ![]() 2NO2(g)的平衡常数Kp=___kPa(Kp为以分压表示的平衡常数,是指平衡时体系中生成气体压强幂之积与反应物气体压强幂之积的比值。计算结果保留3位小数)。
2NO2(g)的平衡常数Kp=___kPa(Kp为以分压表示的平衡常数,是指平衡时体系中生成气体压强幂之积与反应物气体压强幂之积的比值。计算结果保留3位小数)。
(4)铈元素(Ce)是镧系金属中自然丰度最高的一种,常见有+3、+4两种价态。雾霾中含有大量的污染物NO,可以被含Ce4+的溶液吸收,生成NO2-、NO3-(两者物质的量之比为1:1)。可采用电解法将上述吸收液中的NO2-转化为无毒物质,同时再生Ce4+,其原理如图所示。

①Ce4+从电解槽的_____(填字母代号)口流出。
②写出阴极的电极反应式:______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,可逆反应2NO2![]() 2NO+O2在恒容密闭容器中反应,达到平衡状态的标志是:
2NO+O2在恒容密闭容器中反应,达到平衡状态的标志是:
①单位时间内生成nmol O2的同时生成2nmol NO2;
②单位时间内生成nmol O2 的同时生成2nmol NO;
③用NO2、NO、O2的物质的量浓度变化表示的反应速率的比为2∶2∶1的状态;
④混合气体的颜色不再改变的状态;
⑤密闭容器中压强不再改变的状态;
⑥混合气体的平均相对分子质量不再改变的状态。
A. ①④⑤⑥B. ②③⑤⑥C. ①③④⑥D. 全部
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在200 mL含Mg2+、Al3+、NH4+、H+、Cl-等离子的溶液中,逐滴加入5molL-1的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生沉淀的物质的量(mol)关系如图所示。
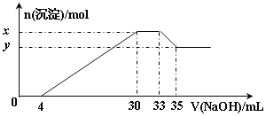
下列叙述不正确的是( )
A.原溶液中c(Cl-)=0.75 mol·L-1
B.x与y的差值为0.01 mol
C.原溶液的pH=1
D.原溶液中n(Mg2+):n(Al3+)=10:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用铝土矿(主要成分为Al2O3,含Fe2O3杂质)为原料冶炼铝的工艺流程如下:

下列叙述不正确的是( )
A.试剂X可以是氢氧化钠溶液
B.反应①过滤后所得沉淀为氧化铁
C.图中所示转化反应包含氧化还原反应
D.反应②的化学方程式为2NaAlO2+3H2O+CO2=2Al(OH)3↓+Na2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于常见有机化合物的说法中,正确的是( )
A.乙烯和聚乙烯都能与溴的四氯化碳溶液发生加成反应
B.分子式为![]() 的有机物只有三种,它们互为同分异构体
的有机物只有三种,它们互为同分异构体
C.石油、天然气和煤的主要成分都是烷烃
D.己烯和苯都能使溴水褪色,故不能用溴水鉴别己烯和苯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)某同学采用萃取—分液的方法从碘水中提取碘,主要操作步骤如下图:

①该同学所采用的萃取剂可能是______________(填序号)。
A 酒精 B 苯 C 四氯化碳 D 汽油
②甲、乙、丙3步实验操作中,不正确的是_______________(填“甲”、“乙”或“丙”)。
(2)实验室制取、净化并收集氯气涉及以下几个主要阶段:

现有以下2种试剂:A 饱和食盐水 B NaOH溶液
请在以上实际中选择填空(填“A”或“B”):
①X溶液应选用________________。
②尾气处理过程中,多余的氯气可用________________吸收。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学——选修5:有机化学基础]
甲叉琥珀酸,又名亚甲基丁二酸,在精细化工领域有着广泛的用途,其合成路线如下: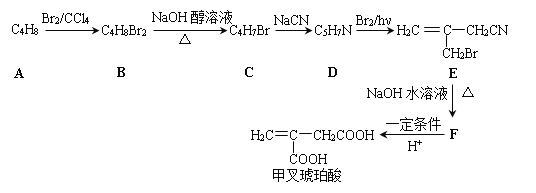
已知:![]()
回答下列问题:
(1)甲叉琥珀酸中官能团的名称为_______,_______。
(2)A的名称为_______,A→B的化学方程式为_______。
(3)B→C的化学方程式为_______,C→D的反应类型为_______。
(4)F的结构简式为_______。
(5)甲叉琥珀酸的同分异构体M也是不饱和二元羧酸,则M共有 _______种(不考虑立体异构),其中核磁共振氢谱显示三组峰,且峰面积之比为3∶1∶2的结构简式为 _______。
(6)根据上述信息,写出用一氯甲苯(![]() CH2Cl)为原料(无机试剂任选)制备苯乙酸(
CH2Cl)为原料(无机试剂任选)制备苯乙酸(![]() CH2COOH)的合成路线_______。
CH2COOH)的合成路线_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝是应用广泛的金属。以铝土矿(主要成分为Al2O3,含SiO2和Fe2O3等杂质)为原料制备铝的一种工艺流程如下:

注:SiO2在“碱溶”时转化为铝硅酸钠沉淀。
(1)“碱溶”时生成偏铝酸钠的离子方程式为_____________________。
(2)向“过滤Ⅰ”所得滤液中加入NaHCO3溶液,溶液的pH_________ (填“增大”、“不变”或“减小”)。
(3)“电解Ⅰ”是电解熔融Al2O3,电解过程中作阳极的石墨易消耗,原因是___________。
(4)“电解Ⅱ”是电解Na2CO3溶液,原理如图所示。阳极的电极反应式为_____________________,阴极产生的物质A的化学式为____________。

(5)铝粉在1000℃时可与N2反应制备AlN。在铝粉中添加少量NH4Cl固体并充分混合,有利于AlN的制备,其主要原因是_____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com