
【题目】硫酸锰在电解锰、染料、造纸以及陶瓷等工业生产中有广泛的应用。利用软锰矿(主要成分为MnO2,含铁的化合物等杂质)和闪锌矿(主要成分ZnS)制得硫酸锰的流程如下:
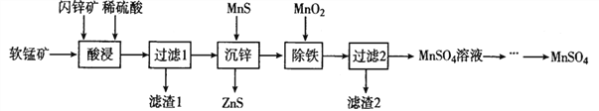
(1)“酸浸”时,为了缩短浸取时间,常加入少量FeSO4溶液,FeSO4的作用可能是___________________;MnO2、ZnS及硫酸反应转变为两种硫酸盐的化学方程式为______________________。
(2)常温下,Ksp(ZuS)=1.2×l0-24、Ksp(MnS)=1.5×10-15,“沉锌”反应为:Zn2+(aq)+MnS![]() ZnS+Mn2+(aq),该反应的平衡常数K=__________________。
ZnS+Mn2+(aq),该反应的平衡常数K=__________________。
(3)在强酸性条件下加入MnO2氧化Fe2+的离子方程式为___________________。
(4)“除铁”时需要调节pH约为3~4,过滤所得的滤渣2中除MnO2以外的另一种物质是________________。(写化学式)
(5)该工艺流程中可以循环利用的物质是____________________。
【答案】催化剂 4MnO2+ZnS+4H2SO4=4MnSO4+ZnSO4+4H2O 1.25×109 MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O Fe(OH)3 ZnS
【解析】
(1)因为软锰矿(主要成分为MnO2,含铁的化合物等杂质)和闪锌矿(主要成分ZnS),加稀硫酸会把这些金属氧化物变成离子, “酸浸”时,为了缩短浸取时间,常加入少量FeSO4溶液,FeSO4的作用可能是催化剂的作用,因为催化剂能够改变化学反应的速。MnO2、ZnS及硫酸反应转变为两种硫酸盐的化学方程式为4MnO2+ZnS+4H2SO4=4MnSO4+ZnSO4+4H2O。本题答案:催化剂 4MnO2+ZnS+4H2SO4=4MnSO4+ZnSO4+4H2O。
(2)常温下,Ksp(ZuS)=1.2×l0-24、Ksp(MnS)=1.5×10-15,“沉锌”反应为:Zn2+(aq)+MnS![]() ZnS+Mn2+(aq),该反应的平衡常数K=c(Mn2+)/c(Zn2+)。Ksp(ZuS)= c(Zn2+).c(S2-)
ZnS+Mn2+(aq),该反应的平衡常数K=c(Mn2+)/c(Zn2+)。Ksp(ZuS)= c(Zn2+).c(S2-)
Ksp(MnS)=c(c(Mn2+). c(S2-), Ksp(MnS)/ Ksp(MnS)= c(Mn2+)/c(Zn2+)=K所以K=1.25×109
(3)在强酸性条件下加入MnO2氧化Fe2+的离子方程式为MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O
(4)由(3)知强酸性条件下加入MnO2氧化Fe2+ 变成Fe3+ ,, Ksp(Fe(OH)3)=2.6![]() 10-39“调节pH约为3~4时会出现Fe(OH)3沉淀。本题答案:Fe(OH)3。(写化学式)
10-39“调节pH约为3~4时会出现Fe(OH)3沉淀。本题答案:Fe(OH)3。(写化学式)
(5)由 知该工艺流程中可以循环利用的物质是ZnS。
知该工艺流程中可以循环利用的物质是ZnS。


科目:高中化学 来源: 题型:
【题目】联氨(又称肼,N2H4,无色液体)是一种应用广泛的化工原料,可用作火箭燃料.回答下列问题:
(1)联氨分子的电子式为___________, 其中氮的化合价为___________.
(2)实验室中可用次氯酸钠溶液与氨反应制备联氨,反应的化学方程式为____________.
(3)①2O2(g)+N2(g)═N2O4(l) △H1
②N2(g)+2H2(g)═N2H4(l) △H2
③O2(g)+2H2(g)═2H2O(g) △H3
④2N2H4(l)+N2O4(l)═3N2(g)+4H2O(g) △H4=﹣1048.9kJmol﹣1
上述反应热效应之间的关系式为△H4=______________, 联氨和N2O4可作为火箭推进剂的主要原因为______________________.
(4)联氨为二元弱碱,在水中的电离方式与氨相似.联氨第一步电离反应的平衡常数值为_____ (已知:N2H4+H+N2H5+的K=8.7×107;Kw=1.0×10﹣14).联氨与硫酸形成的酸式盐的化学式为_______________.
(5)联氨是一种常用的还原剂.向装有少量AgBr的试管中加入联氨溶液,观察到的现象是_______________. 联氨可用于处理高压锅炉水中的氧,防止锅炉被腐蚀.理论上1kg的联氨可除去水中溶解的O2__________kg;与使用Na2SO3处理水中溶解的O2相比,联氨的优点是________________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有三种不同堆积方式的金属晶体的晶胞如图所示,有关说法正确的是
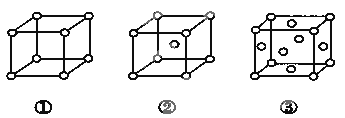
A. ①、②、③依次为简单立方堆积、六方最密堆积、体心立方堆积
B. 每个晶胞含有的原子数分别为:①1个,②2个,③6个
C. 晶胞中原子的配位数分别为:①6, ②8 ,③12
D. 空间利用率的大小关系为:①>②>③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列反应:
①![]() ;ΔH=
;ΔH=![]() 196.6kJmol-1
196.6kJmol-1
②![]() ;ΔH<0
;ΔH<0
③![]() ;ΔH=
;ΔH=![]() 92.4 kJmol-1
92.4 kJmol-1
(1)在一定条件下向一密闭容器中充入1mol SO2和0.5mol O2,充分反应后,放出的热量_________(填“<”“>”“=”)98.3kJ;理由是_____________________;
(2)反应②的化学平衡常数表达式K=___________,温度降低时,K值_______(填“增大”、“减小”或“无影响”);
(3)在0.2L的密闭容器中,加入1.0mol N2 和 3.0mol H2当该反应达到平衡时,测出平衡混合气的总物质的量为3 mol,则平衡时氮气的转化率=___________;
(4)反应③中为有效提高氢气的转化率,理论上可采取的措施有____________________。
A.升高温度 B.增大压强 C.减小压强 D.及时移出氨 E.循环利用和不断补充氢气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的用途主要利用了其化学性质的是( )
①酒精用作燃料;②干冰用于人工降雨;③O2用于医疗急救;④稀有气体填充霓虹灯。
A.①③④B.①③C.③④D.②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向两个体积可变的密闭容器中均充入1mol的A2和2mol的B2发生反应:A2(g)+2B2(g)![]() 2AB2(g) △H。维持两个容器的压强分别为p1和p2,在不同温度下达到平衡,测得平衡时AB2的体积分数随温度的变化如图所示。
2AB2(g) △H。维持两个容器的压强分别为p1和p2,在不同温度下达到平衡,测得平衡时AB2的体积分数随温度的变化如图所示。
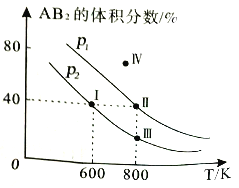
已知:图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上;IV点不在曲线上
下列叙述正确的是
A. Ⅰ点和Ⅱ点反应速率相等 B. IV点时反应未到达平衡v(正)<v(逆)
C. I点时,A的平衡转化率为40% D. 将点II所对应容器冷却到600K,可变成点I
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I、下图是全钒液流电池的示意图
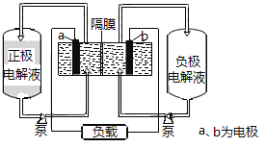
该电池充放电的总反应式为:![]()
请回答下列问题:
(1)充电时的阴极反应式为______________,阳极附近颜色变化是______。
(2)放电过程中,正极附近溶液的pH ________(选填“升高”“降低”或“不变”)。
II、回收利用废钒催化剂(主要成分为V2O5、VOSO4和二氧化硅)的工艺流程如下图所示。
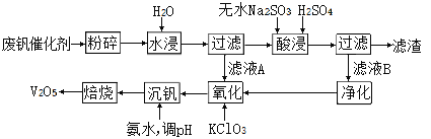
(3)滤渣可用于______________________(填一种用途)。
(4)25℃时,取样进行实验分析,得到钒沉淀率和溶液pH之间的关系如下表所示:
pH | 1.3 | 1.4 | 1.5 | 1.6 | 1.7 | 1.8 | 1.9 | 2.0 | 2.1 |
钒沉淀率(%) | 88.1 | 91.8 | 96.5 | 98 | 99.8 | 97.8 | 96.4 | 93.0 | 89.3 |
根据上表数据判断,加入氨水调节酸碱性,溶液的最佳pH为____;
(5)为了提高钒的浸出率,用酸浸使废钒催化剂中的V2O5转变成可溶于水的VOSO4,酸浸过程中,氧化产物和还原产物的物质的量之比为________。
(6)氧化过程中,VO2+变为VO2+,则该反应的离子方程式为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下在一容积不变的密闭容器中发生可逆反应2X(g) ![]() Y(g)+Z(s),以下不能说明该反应达到化学平衡状态的是( )
Y(g)+Z(s),以下不能说明该反应达到化学平衡状态的是( )
A. 混合气体的密度不再变化 B. 反应容器中Y的质量分数不变
C. X的分解速率与Y的消耗速率相等 D. 单位时间内生成1 mol Y的同时生成2 mol X
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com