
【题目】下列排列顺序不正确的是( )
A.原子半径:Al>Mg>Na
B.酸性:HClO4>H2SO4>H3PO4
C.热稳定性:HF>HCl>H2S
D.元素的非金属性:N<O<F
 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案科目:高中化学 来源: 题型:
【题目】下图是中学教材中元素周期表的一部分,其中标出A-Q14种元素,试回答下列问题:[(1) (2)问用具体的元素符号或离子符号或化学式回答]
A | B | C | D | ||||||||||||||
E | F | G | H | I | J | K | L | ||||||||||
P | Q |
(1)在上表所列出的短周期元素中
①性质最不活泼的是_______;②原子半径最大的是_____(除稀有气体元素)
③形成的气态氢化物最稳定的是_______;
④最高价氧化物对应的水化物中酸性最强的是_______碱性最强的是_______。
⑤形成的阴离子还原性最弱的是_______,阳离子半径最小的是_______。
(2)用电子式表示F与D形成化合物的过程
________________________________________________________________________;
(3)设P的原子序数为Z,则F的原子序数为___________,Q的原子序数为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能证明氢氟酸是弱酸的实验事实是
A.HF溶液与Zn反应放出H2
B.0.1mol/LNaF溶液的pH大于7[
C.HF溶液与Na2CO3反应生成CO2
D.0.1mol/LHF溶液可使紫色石蕊变红
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应A2+B2 ![]() 2AB在不同条件下,产物AB百分含量随时间变化关系如图所示,a为500℃,b为300℃时情况,c为300℃时从时间t3开始向容器中加压的情况,则下列叙述正确的是( )
2AB在不同条件下,产物AB百分含量随时间变化关系如图所示,a为500℃,b为300℃时情况,c为300℃时从时间t3开始向容器中加压的情况,则下列叙述正确的是( )
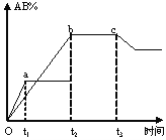
A.AB为固体,A2、B2中最少有一种为非气体,正反应吸热
B.AB为气体,A2、B2中最少有一种为非气体,正反应吸热
C.AB为气体,A2、B2中最少有一种为非气体,正反应放热
D.A2、B2、AB均为气体,正反应放热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是
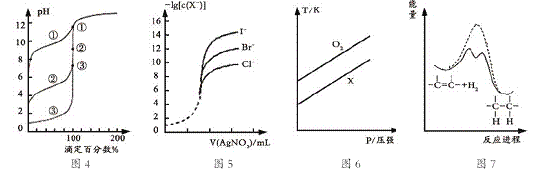
A. 用0.1000mol/LNaOH溶液分别滴定浓度相同的三种一元酸,由图4曲线确定①的酸性最强
B. 用0.0100mol/L硝酸银标准溶液,滴定浓度均为0.1000mol/LCl-、Br-及I-的混合溶液,由图5曲线,可确定首先沉淀的是Cl-
C. 在体积相同的两个密闭容器中,分别充入相同质量O2和X气体,由图6可确定X可能是CH4气体
D. 由图7可说明烯烃与H2加成反应是放热反应,虚线表示在有催化剂的条件下进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸钴是制作氧化钴和金属钴的原料。一种利用含钴废料(主要成分Co2O3),含少量Fe2O3、MnO2、Al2O3、CaO、MgO、碳及有机物等)制取草酸钴(CoC2O3)的工艺流程如下:
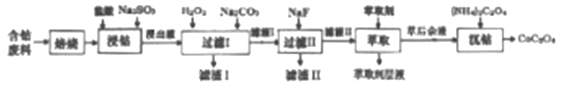
已知:①浸出液中含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等。
②部分阳离子一氢氧化物形式沉淀时溶液的pH见下表:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
完全沉淀时的pH | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
③Kap(MgF2)=7.35×10-11,Kap(CaF2)=1.05×10-10
回答下列问题:
(1)焙烧的目的是_________;浸钴过程中Co3+转化为Co2+,反应的离子方程式为_____________。
(2)加入H2O2的目的是__________,加入Na2CO3溶液,调pH至5.2,滤渣Ⅰ主要成分为__________。
(3)加入过量NaF溶液,可将Ca2+、Mg2+除去,若所得滤液中c(Ca2+)=1.0×10-5mol·L-1,则滤液中c(Mg2+)为_______________。
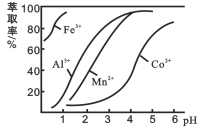
(4)萃取剂对金属离子的萃取率与pH的关系如下图所示。滤液Ⅱ中加入萃取剂的作用是_________;萃取时,溶液的pH需要控制在一定范围内才比较适宜,其pH范围约为__________。
(5)已知含钴废料中含Co2O3质量分数为a%,若取mg该含钴废料按照上述流程,理论上最多能制得CoC2O4的质量为__________g(列出计算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图表示向某溶液中滴加Ba(OH)2溶液时,沉淀的物质的量随Ba(OH)2的物质的量的变化关系。该溶液的成分可能是( )

A.MgSO4
B.KAl(SO4)2
C.Al2(SO4)3
D.NaAlO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学——选修3:物质结构与性质]
原子序数依次增大的A、B、C、D、E、F六种元素。其中A的基态原子有3个不同的能级,各能级中的电子数相等;C的基态原子2p能级上的未成对电子数与A原子的相同;D为它所在周期中原子半径最大的主族元素;E和C位于同一主族,F的原子序数为29。
(1)F基态原子的核外电子排布式为______________________。
(2)在A、B、C三种元素中,第一电离能由小到大的顺序是___________(用元素符号回答)。
(3)元素B的简单气态氢化物的沸点___________(填“高于”或“低于”)元素A的简单气态氢化物的沸点,其主要原因是______________________。
(4)由A、B、C形成的离子CAB与AC2互为等电子体,则CAB的结构式为___________。
(5)在元素A与E所形成的常见化合物中,A原子轨道的杂化类型为___________。
(6)由B、C、D三种元素形成的化合物晶体的晶胞如图所示,则该化合物的化学式为___________。
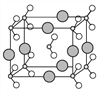
(7)FC在加热条件下容易转化为F2C,从原子结构的角度解释原因______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com