
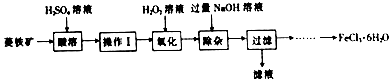
分析 以菱铁矿(主要成分为FeCO3,含有SiO2、Al2O3)为原料,加入稀硫酸酸溶过滤得到滤液为硫酸铝、硫酸亚铁溶液,滤渣为SiO2,滤液中加入过氧化氢氧化亚铁离子为铁离子,加入过量氢氧化钠溶液沉淀铁离子,过滤得到氢氧化铁,滤液为偏铝酸钠和氢氧化钠的混合溶液,向过滤后所得固体,用水洗涤固体2-3次,加入稀盐酸使固体完全溶解,在氯化氢氛围内蒸发浓缩、冷却结晶,过滤,低温干燥,得到FeCl3•6H2O,据此分析解答.
解答 解:(1)酸溶及后续过程中均需保持算过量,其目的除了提高铁元素的浸出率之外,还有抑制Fe3+水解;
故答案为:抑制Fe3+水解;
(2)向菱铁矿加稀硫酸,二氧化硅不溶,从流程可知二氧化硅被除去,故操作Ⅰ为过滤;
故答案为:过滤;
(3)滴加H2O2溶液氧化时,发生主要反应的离子方程式为:H2O2+2Fe2++2H+=2Fe3++2H2O;
故答案为:H2O2+2Fe2++2H+=2Fe3++2H2O;
(4)检验铁元素全部以Fe3+形式存在,即检验是否有亚铁离子即可,方法为:取少许氧化后的溶液于试管中,向试管中滴加1-2滴酸性高锰酸钾溶液,紫色不褪去,说明铁元素全部以Fe3+形式存在;
故答案为:取少许氧化后的溶液于试管中,向试管中滴加1-2滴酸性高锰酸钾溶液,紫色不褪去,说明铁元素全部以Fe3+形式存在;
(5)经过氧化氢氧化后的溶液有铁离子和铝离子,加入过量NaOH溶液的目的是,将Al3+转化为AlO2-,分离Fe3+与Al3+;
故答案为:将Al3+转化为AlO2-,分离Fe3+与Al3+;
(6)过滤后得到的固体为氢氧化铁,由氢氧化铁制备FeCl3•6H2O的实验方案为:向过滤后所得固体,用水洗涤固体2-3次,加入稀盐酸使固体完全溶解,在氯化氢氛围内蒸发浓缩、冷却结晶,过滤,低温干燥,得到FeCl3•6H2O;
故答案为:加入稀盐酸使固体完全溶解,在氯化氢氛围内蒸发浓缩、冷却结晶,过滤.
点评 本题考查物质的制备实验及混合物的分离和提纯,为高频考点,把握流程图中每一步发生的反应及操作方法是解本题关键,注意结合题给信息解答,侧重分析与实验能力的考查,题目难度中等.


科目:高中化学 来源: 题型:解答题
 ;氯离子的电子式
;氯离子的电子式 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
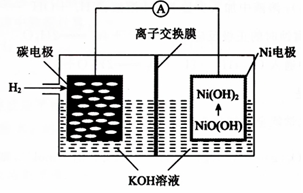
| A. | 离子交换膜选用阳离子交换膜(只允许阳离子通过) | |
| B. | 正极的电极反应为NiO(OH)+H2O+e-═Ni(OH)2+OH- | |
| C. | 导线中通过1mol电子时,理论上负极区溶液质量增加1g | |
| D. | 充电时,碳电极与电源的正极相连 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 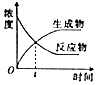 图表示某可逆反应物质的浓度随时间的变化,且在t时刻达到平衡状态 | |
| B. | 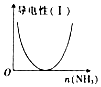 图表示向CH3COOH溶液中通入NH3至过量的过程中溶液导电性的变化 | |
| C. |  图表明合成氨反应时放热反应,b表示在反应体系中加入了催化剂 | |
| D. | 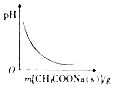 图表示向CH3COOH溶液中逐渐加入CH3COONa固体后,溶液pH的变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| t/min | 0.00 | 1.00 | 2.00 | 3.00 | 4.00 | 5.00 |
| c(N2O5)/(mol•L-1) | 1.00 | 0.71 | 0.50 | 0.35 | 0.25 | 0.17 |
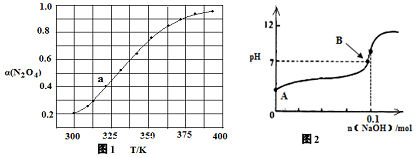
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碘单质升华,克服的是其分子间作用力 | |
| B. | 金刚石、石墨、纳米碳管是碳元素的同素异形体 | |
| C. | 目前科学家还无法实现对原子或分子的操纵 | |
| D. | HCl气体溶于水后,共价键被破坏,从而形成了H+和Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
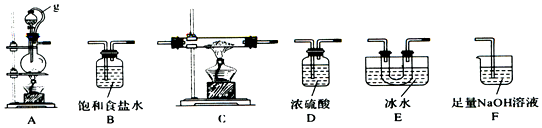
| 实验序号 | 0.1mol/L NaClO溶液/mL | 0.1mol/L NaCl溶液/mL | 0.2mol/L NaOH溶液/mL | H2O/mL | 品红溶液 | 现象 |
| ① | 4.0 | 0 | 0 | 4.0 | 3滴 | 较快褪色 |
| ② | 0 | 4.0 | 4.0 | 0 | 3滴 | 不褪色 |
| ③ | 4.0 | 0 | 4.0 | 0 | 3滴 | 缓慢褪色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com